Unravelling the mystery that makes viruses infectious
(University of Leeds – بواسطة جامعة ليدز)
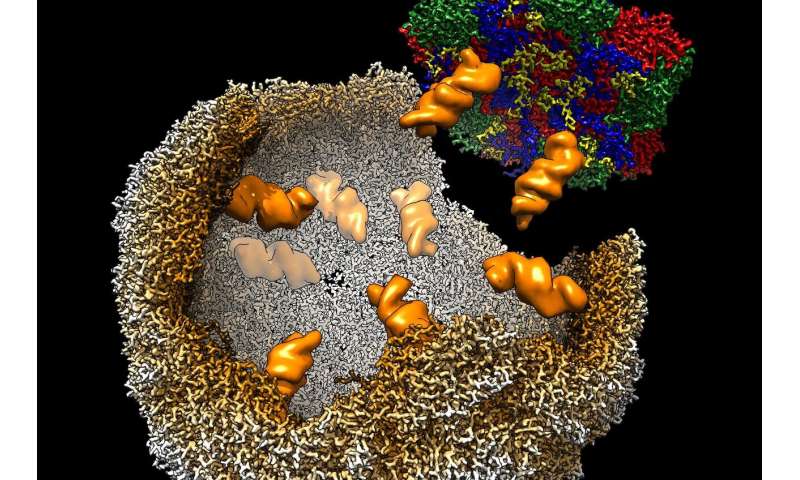
ويحتاج الفيروس، بمجرد إصابة الخلية، إلى نشر مادته الجينية إلى خلايا أخرى. وهذه عملية معقدة تنطوي على إنشاء ما يعرف بـ”فيريونات” (virions) [٣] وهي نسخ معدية متشكلة من الفيروس. فكل فيريون هو عبارة عن غلاف بروتيني يحتوي على نسخة كاملة من الشفرة الجينية للفيروس. ومن ثَمَّ يمكن للفيريونات أن تصيب خلايا أخرى وتسبب المرض. ما كان لغزا حتى الآن، هو فهمٌ مفصل لطريقة تجميع الفيروس لفيريوناته.
“هذه الدراسة مهمة للغاية، نظرًا للطريقة التي تغير بها تفكيرنا حول كيف نستطيع التحكم في بعض الأمراض الفيروسية؛ فإذا تمكنا من تعطيل آلية تكوين الفيروس، فهناك احتمال لوقف العدوى في مساراتها” كما قال البروفيسور بيتر ستوكلي (Peter Stockley)، المدير السابق لمركز أستبوري لعلم الأحياء الجزيئي الانشائي (Astbury Centre for Structural Molecular Biology) في جامعة ليدز، والذي أشرف مع البروفيسور ريدون تواروك (Reidun Twarock) من جامعة يورك على البحث جزئيًا.
وأضاف: “يشير تحليلنا إلى أن السمات الجزيئية التي تتحكم في عملية تكوين الفيروس محفوظة وراثيًا، مما يعني أنها لا تتطور بسهولة – مما يقلل من خطر أن يتغير الفيروس ويجعل أي دواء جديد غير فعال”.
ويجمع البحث في جامعتي ليدز ويورك خبراء في التركيب الجزيئي للفيروسات والمجهر الالكتروني وعلم الأحياء الرياضي. وتركز الدراسة على فيروس بقري غير ضار وغير معدي لدى البشر، وهو فيروس معوي إي (Enterovirus-E) وهو البديل المعتمد عالميًا لفيروس شلل الأطفال، الفيروس الخطير الذي يصيب الناس ويسبب شلل الأطفال. وهذا الفيروس هو هدف لمبادرة منظمة الصحة العالمية للقضاء عليه. وتشمل مجموعة الفيروسات المعوية أيضًا فيروسات الأنف البشرية، التي تسبب نزلات البرد.
وتعدد الدراسة، التي نشرت في ٩ يناير ٢٠٢١ ، دور ما يسمى إشارات التعبئة والتغليف للحمض النووي الريبي (RNA) والمناطق القصيرة من جزيء الحمض النووي الريبي الذي – جنبا إلى جنب مع البروتينات من غلاف الفيروس – يضمن تشكيل دقة وكفاءة الفيريون المعدي. وباستخدام مزيج من علم الأحياء الجزيئي والرياضي، تمكن الباحثون من التعرف على المواقع المحتملة على جزيء الحمض النووي الريبي التي يمكن أن تعمل كإشارات تغليف. وباستخدام المجاهر الإلكترونية المتقدمة في مختبر استبوري للبيئة الحيوية (Astbury Biostructure) في جامعة ليدز، تمكن العلماء من تصور هذه العملية بشكل مباشر – وهي المرة الأولى التي كان فيها ممكنًا مع أي فيروس من هذا النوع.
وأضاف البروفيسور تواروك: “إن الفهم التفصيلي لكيفية عمل هذه العملية ، وحقيقة أنها تبدو محفوظة في عائلة كاملة من مسببات الأمراض الفيروسية ، سيمكن صناعة الأدوية من تطوير عوامل مضادة للفيروسات يمكنها منع هذه التفاعلات الرئيسية والوقاية من الأمراض”.
*تمت الترجمة بتصرف
المصدر:
https://phys.org/news/2021-01-unravelling-mystery-viruses-infectious.html
لمزيد من المعلومات: ريبيكا تشاندلر-بوستوك وآخرون ، Assembly of infectious enteroviruses depends on multiple, conserved genomic RNA-coat protein contacts, PLOS Pathogens (2020). DOI: 10.1371/journal.ppat.1009146
الهوامش:
[١] القفيصة هي غلاف بروتيني للفيروس، يحيط بمواده الوراثية. وتتكون من عدة وحدات فرعية هيكلية قليلة القسيمات (متكررة) مصنوعة من بروتين يسمى البروتومرات. الوحدات الفرعية المورفولوجية ثلاثية الأبعاد التي يمكن ملاحظتها، والتي قد تتوافق أو لا تتوافق مع البروتينات الفردية ، تسمى كابسوميرات (capsomeres). ويكيبيديا [٢] مجلة بي إل أو اس باثوجينس (PLOS Pathogens) هي مجلة طبية محكمة (خاضعة لمراجعة الأقران) مفتوحة الوصول. وبدأت عملها في سبتمبر ٢٠٠٥، وكانت هي المجلة الخامسة للمكتبة العامة للعلوم (ناشر غير ربحي مفتوح الوصول). ويكيبيديا [٣] الفيريون: هو جسيم فيروسي كامل يتكون من الحمض النووي الريبي أو الحمض النووي المحاط بقشرة بروتينية، ويشكل الشكل المعدي للفيروس. وتحمي قشرة أو قفيصة الفيريون اللب الداخلي الذي يتضمن الجينوم والبروتينات الأخرى. بعد أن يرتبط الفيروس بسطح خلية مضيفة معينة، يتم حقن الحمض النووي او الحمض النويي الريبي في الخلية المضيفة ويحدث تكاثر الفيروس، مما يؤدي إلى انتشار العدوى إلى الخلايا المضيفة الأخرى. الفيريون هو الجسيم المعدي المصمم لنقل جينوم الحمض النووي بين العوائل أو الخلايا المضيفة. ويتم إنتاج الفيروسات في سيتوبلازم “مصانع” الفيروس المعقدة.
 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية
