Key Parkinson’s Protein Structure And Malfunction Revealed For First Time
(بقلم: ديفيد نيلد – David Nield)
كشف الباحثون عن أول نظرة فعلية على بروتين “ميتوكوندريا” مرتبط ارتباطًا وثيقًا بمرض باركنسون، كاشفين عن تفاصيل رئيسية حول كيفية لعب خلله دورًا حاسمًا في تطور المرض.
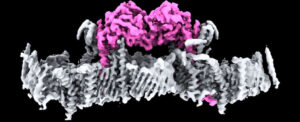
عرف العلماء لأكثر من عقدين أن الطفرات في جين بروتين يُسمى “كيناز 1 المُستحث بواسطة بتين” (PTEN-induced putative kinase 1 (PINK1)) [المترجم: بتين[1] (PTEN) هو متماثل الفوسفاتوز والتنسين؛ (PHOSPHATASE AND TENSIN HOMOLOG)] يمكن أن تُحفز ظهور مرض باركنسون المُبكر، إلا أن الآليات المُتحكمة في ذلك ظلت لغزًا.
وقد استخدم فريق من العلماء من معهد “والتر وإليزا هول” للأبحاث الطبية (WEHI) في أستراليا تقنية تصوير متقدمة ليس فقط لتحديد بنية “كيناز 1 المُستحث بواسطة بتين”، ولكن أيضًا لإظهار كيفية ارتباطه بالمراكز الحيوية الخلوية وكيفية تنشيطها.
ويقول البروفيسور ديفيد كوماندر، عالم الأحياء الطبية في معهد “والتر وإليزا هول” للأبحاث الطبية: “يُمثل هذا إنجازًا هامًا في أبحاث مرض باركنسون”.
ويضيف: “إنه لأمرٌ مذهل أن نرى أخيرًا بروتين ‘كيناز 1 المُستحث بواسطة بتين‘ ونفهم كيفية ارتباطه بالميتوكوندريا. يكشف تركيبنا عن العديد من الطرق الجديدة لتغيير بروتين ‘كيناز 1 المُستحث بواسطة بتين‘، أي تفعيله، وهو ما سيُغير حياة مرضى باركنسون”.
ويُعد بروتين “كيناز 1 المُستحث بواسطة بتين” عامل صيانة مهم في الجسم. وفي الميتوكوندريا السليمة، يمر البروتين عبر الأغشية الخارجية والداخلية، حيث يختفي عن الأنظار.
وفي الميتوكوندريا المتكسرة (المتحللة)، يُجبر البروتين على التوقف في منتصف الطريق، مُنبهًا مركز الطاقة للحذف من خلال سلسلة من العمليات التي تُطلق إشارة كيميائية تُسمى اليوبيكويتين. وعندما تمنع الطفرات بروتين “كيناز 1 المُستحث بواسطة بتين” من أداء وظيفته، لا يتم التخلص من الميتوكوندريا المُختلة.
وتستهلك خلايا الدماغ كميات كبيرة من الطاقة، مما يجعل استبدال وحدات الطاقة غير الفعالة أمرًا حيويًا لمنع التنكس العصبي الذي يُسبب حالات مثل مرض باركنسون.
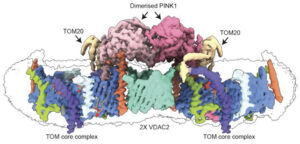
وفي هذه الدراسة، استخدم الفريق تقنيات تشمل المجهر الإلكتروني بالتبريد ومطياف الكتلة لدراسة بروتين “كيناز 1 المُستحث بواسطة بتين” والميتوكوندريا عن كثب، ووجدوا أن ارتباطهما يعتمد على مركب بروتيني محدد يُسمى “توم-في داك”[2] (TOM-VDAC).
ولا يزال هذا البحث في مراحله الأولى، ولكن إذا أمكن تطوير علاجات لإصلاح وظيفة البروتين، فقد يُتيح لنا ذلك طريقة لتقليل خطر الإصابة بمرض باركنسون أو إبطاء تقدمه.
وتقول سيلفي كاليجاري، مسؤولة الأبحاث الأولى وعالمة الكيمياء الحيوية من معهد “والتر وإليزا هول” للأبحاث الطبية: “هذه هي المرة الأولى التي نرى فيها بروتين “كيناز 1 المُستحث بواسطة بتين البشري مُلتحمًا بسطح الميتوكوندريا التالفة، وقد كشف ذلك عن مجموعة رائعة من البروتينات التي تعمل كموقع للالتحام”.
وتتابع: “كما رأينا، ولأول مرة، كيف تؤثر الطفرات الموجودة لدى الأشخاص المصابين بمرض باركنسون على بروتين ‘كيناز 1 المُستحث بواسطة بتين‘ البشري”.
ويُعدّ مرض باركنسون مرضًا معقدًا، وله بلا شك عوامل مُساهمة عديدة. ومع ذلك، بتحديد الآليات الكامنة وراء بروتينات مثل “كيناز 1 المُستحث بواسطة بتين”، يقترب الباحثون من فهم العوامل المشتركة بين هذه الأسباب العديدة. وقد نُشر البحث في مجلة “العلوم”. [(Science) الرابط: Structure of human PINK1 at a mitochondrial TOM-VDAC array | Science].
*تمت الترجمة بتصرف
المصدر:
الهوامش:
[1] يُعطي جين “بتين” (PTEN) تعليماتٍ لإنتاج إنزيمٍ موجودٍ في جميع أنسجة الجسم تقريبًا. ويعمل هذا الإنزيم ككابحٍ للأورام، أي أنه يُساعد على تنظيم انقسام الخلايا عن طريق منع نموها وانقسامها (تكاثرها) بسرعةٍ كبيرةٍ أو بشكلٍ غير مُتحكّمٍ به. المصدر: https://medlineplus.gov/genetics/gene/pten
[2] “توم” (TOM) هي اختصار لمجمع الغشاء الخارجي للميتوكوندريا (Translocase of the outer mitochondrial membrane) و هو بوابة الدخول الرئيسية لبروتينات السلف للميتوكوندريا التي يتم تصنيعها على الريبوسومات السيتوبلازمية. المصدر: https://www.nature.com/articles/s41421-020-00198-2 . أما “في داك” (VDAC) فهي اختصار قناة الأنيون المعتمدة على الجهد (voltage-dependent anion channel) والمعروفة أيضًا باسم بورين الميتوكوندريا. وتقع قناة الأنيون المعتمدة على الجهد في الغشاء الخارجي للميتوكوندريا، وتعمل كبوابة لدخول وخروج نواتج أيض الميتوكوندريا، وبالتالي تتحكم في التفاعل المتبادل بين الميتوكوندريا وباقي الخلية. كما تلعب قناة الأنيون المعتمدة على الجهد دورًا رئيسيًا في موت الخلايا المبرمج بوساطة الميتوكوندريا. المصدر: https://pmc.ncbi.nlm.nih.gov/articles/PMC8305817.

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية