حياة الإنسان ككيان في هذه الحياة عبارة عن مجموعة من التفاعلات مع ما حوله من المحسوسات المادية أو التجاذبات العقلية والفكرية. فالإنسان يتعامل يوميا مع ما حوله من الماديات بما يحتّمه عليه الطبع الإنساني وهذا الجزء يتكفل به علم الفيزياء أو الطبيعة فنراه يستخدم القوة والآلة وقوانينهما وأدواتهما لإنجاز أمر ما في دائرة الحسِّ والمشاهدة.
وهناك أمور لا نرى إلا نتاجها كاحتراق المواد وتوليد الطاقة والتفاعلات الكيميائية. وهذا يتكفل به علم الكيمياء. فالإنسان حينما يفاعل فرضا مادة الصوديوم مع الماء يرى نارا وذلك نتيجة إحتراق الهيدروجين مع الأوكسجين في الهواء ومحلولا قلويا وهو هيدروكسيد الصوديوم. أما كيف حدث هذا وبتعبير أدق ما هي التغيرات في خط سير التفاعل، فهي لا ترى بالعين المجرّدة. ومن هنا سمي هذا العلم بالكيمياء من كَمَى الشيء إذا أختفى.

فعلم الكيمياء والفيزياء من أشد العلوم إلتصاقا بحياة الإنسان اليومية منذ أن خلقه الله على هذه الارض. والذرة هي المكون الأساس لجميع المواد التي يتعامل معها هذا الإنسان، فيا ترى ماهي الذرة التي هي أس علم الكيمياء.
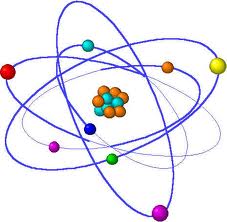
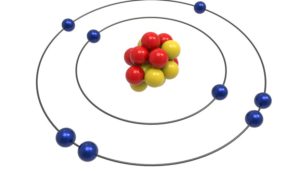
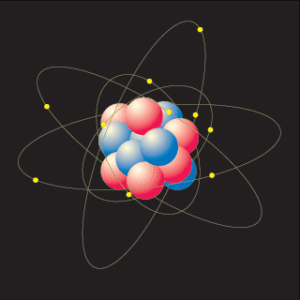 الذرة عبارة عن نواة تحوي عددا من الشحنات الموجبة وتسمى البروتونات وعددا من الشحنات المتعادلة وتسمى النيوترونات. وتوجد هناك عدة مدارات وهمية حول النواة تحوي عددا من الشحنات السالبة وتسمى الإلكترونات.
الذرة عبارة عن نواة تحوي عددا من الشحنات الموجبة وتسمى البروتونات وعددا من الشحنات المتعادلة وتسمى النيوترونات. وتوجد هناك عدة مدارات وهمية حول النواة تحوي عددا من الشحنات السالبة وتسمى الإلكترونات.
ومن المعروف أن في كل ذرة هناك عدد متساوي من البروتونات والإلكترونات.
تختلف الذرات عن بعضها البعض في عدد البروتونات والنيوترونات والإلكترونات وبالتالي في حجم الذرات والإلفة الإلكترونية. فبعض الذرات المتساوية في عدد الدورات والمختلفة في عدد الإلكترونات الخارجية تختلف في طاقة تأيّنها أي قابليتها لكسب أو فقد إلكتروناتها.
 فنلاحظ مثلا أن الصوديوم أسرع تأيّنا من المجنيزيوم في نفس الدورة وذلك لأن الصوديوم يحوي فقط إلكترونا واحد في مداره الأخير بينما المجنيزيوم يحوي إثنان من الإلكترونات وذلك يتطلب طاقة تأيّن أعلى من الصوديوم. بينما نلاحظ في نفس المجموعة أن الباريوم أسرع تأيّنا من المجنيزيوم مع العلم أن كليهما يحوي عدد متساوي من الإلكترونات في المدار الأخير وذلك عائد إلى حجم الذرة. فكلما كبر حجم الذرة سهل إنتزاع إلكتروناتها الخارجية وذلك لبعدها عن قوة الجذب المركزية. ألا وهي النواة التي تحوي شحنات موجبة (بروتونات).
فنلاحظ مثلا أن الصوديوم أسرع تأيّنا من المجنيزيوم في نفس الدورة وذلك لأن الصوديوم يحوي فقط إلكترونا واحد في مداره الأخير بينما المجنيزيوم يحوي إثنان من الإلكترونات وذلك يتطلب طاقة تأيّن أعلى من الصوديوم. بينما نلاحظ في نفس المجموعة أن الباريوم أسرع تأيّنا من المجنيزيوم مع العلم أن كليهما يحوي عدد متساوي من الإلكترونات في المدار الأخير وذلك عائد إلى حجم الذرة. فكلما كبر حجم الذرة سهل إنتزاع إلكتروناتها الخارجية وذلك لبعدها عن قوة الجذب المركزية. ألا وهي النواة التي تحوي شحنات موجبة (بروتونات).  هذا الإختلاف في طاقة التأيّن وغيره هو المسئول الرئيس عن ثبات الذرة وتفاعلاتها مع غيرها من الذرات والمركبات وبالتالي عن نواتج تفاعلاتها. وكل ذلك خاضع لشروط وظروف التفاعل التي عادة ما يتحكم بها الإنسان من طاقة حرارية أو مواد محفزة وغيرها. وقد إمتدت يد الإنسان لتتلاعب بظروف كثير من التفاعلات الكيميائية على وجه الأرض بذكاء أو إن شئت بغباء كي تساهم في بناء أو تساهم في تدمير الحياة على كوكب الأرض، وما القنابل النووية الا خير شاهد على ذلك.
هذا الإختلاف في طاقة التأيّن وغيره هو المسئول الرئيس عن ثبات الذرة وتفاعلاتها مع غيرها من الذرات والمركبات وبالتالي عن نواتج تفاعلاتها. وكل ذلك خاضع لشروط وظروف التفاعل التي عادة ما يتحكم بها الإنسان من طاقة حرارية أو مواد محفزة وغيرها. وقد إمتدت يد الإنسان لتتلاعب بظروف كثير من التفاعلات الكيميائية على وجه الأرض بذكاء أو إن شئت بغباء كي تساهم في بناء أو تساهم في تدمير الحياة على كوكب الأرض، وما القنابل النووية الا خير شاهد على ذلك.
و لنتكلم عن الألوان بما أننا نتكلم عن الذرة. هناك مدارات للذرة أعطيت أسماء, الأقرب فالأقرب الى النواة:
 مدار (سين) (s)
مدار (سين) (s)
مدار (باء) (p)
مدار (دال) (d)
و مدار (فاء) (f)
و مدار دال هو المسؤول عن الألوان و عن رؤية الألوان. و الحقيقة أنه ليس هناك ألوان على مستوى الحقيقة و الواقع.
و لنضرب مثلا حيا:
 ثمرة النخل؛ تبدأ خضراء كما نتوهم, ثم تتحول إلى صفراء أو حمراء أو قد تبقى خضراء, ثم يتحول جميع الثمار إلى البني أو الأسود.
ثمرة النخل؛ تبدأ خضراء كما نتوهم, ثم تتحول إلى صفراء أو حمراء أو قد تبقى خضراء, ثم يتحول جميع الثمار إلى البني أو الأسود.
لو كان اللون ثابتا لبقيت الثمرة كما هي. أين السر؟
مدارات دال عندما يسقط عليها الضوء (طاقة ضوئية), فإن هذه المدارات تطلق حزمة من الموجات الضوئية.
 و الله سبحانه و تعالى زودنا بحساسات, تتفاعل مع الموجات المنبعثة من مدارات دال.
و الله سبحانه و تعالى زودنا بحساسات, تتفاعل مع الموجات المنبعثة من مدارات دال.
فبحسب طول الموجة أو قصرها الساقطة على العين, اصطلحنا و أعطينا كلَّ موجة إسما إعتباريا.
فأعطينا بعض الموجات مصطلحا, فقلنا: هذا أبيض و ذاك أحمر و أصفر و أزرق و هكذ دواليك.
أما سمعت عن أناسٍ, عندهم عمى ألوان.
و ليس ذلك خلل في الموجات, بل خلل في المُسْتَقْبِل و الحساسات, التي أنعم الله بها علينا.
فحافظوا على هذه النعمة و جنبوها ما يؤذيها.
 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية

مختصر وحاسم ..ممتاز👍