Carbon bond that uses only one electron seen for first time: ‘It will be in the textbooks’
(Katherine Bourzac – بقلم: كاثرين بورزاك)
يساهم الاكتشاف الأساسي في تعميق فهم العلماء للترابط الكيميائي.
منذ أكثر من قرن بقليل، اعتقد الكيميائيون أن الروابط الذرية القوية التي تسمى الروابط التساهمية تتشكل عندما تتقاسم الذرات زوجًا واحدًا أو أكثر من أزواج الإلكترونات. والآن، أجرى الباحثون أول ملاحظات على الروابط التساهمية أحادية الإلكترون بين ذرتين من الكربون.

وقد شوهد هذا السلوك الرابط غير المعتاد بين عدد قليل من الذرات الأخرى، لكن العلماء متحمسون بشكل خاص لرؤيته في الكربون، اللبنة الأساسية للحياة على الأرض والمكون الرئيسي للمواد الكيميائية الصناعية بما في ذلك الأدوية والبلاستيك والسكريات والبروتينات. وقد نُشر الاكتشاف[1] في مجلة “نيتشر (Nature)” في 25 سبتمبر [2024].
ويقول الكيميائي البروفيسور تاكويا شيماجيري [استاذ مساعد] من جامعة طوكيو، والذي كان جزءًا من فريق البحث في الروابط الكربونية: “الرابطة التساهمية هي واحدة من أهم المفاهيم في الكيمياء، واكتشاف أنواع جديدة من الروابط الكيميائية يحمل وعدًا كبيرًا بتوسيع مناطق شاسعة من الفضاء الكيميائي”.
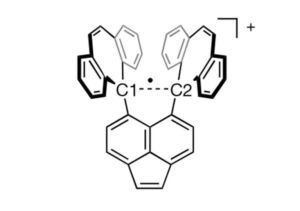
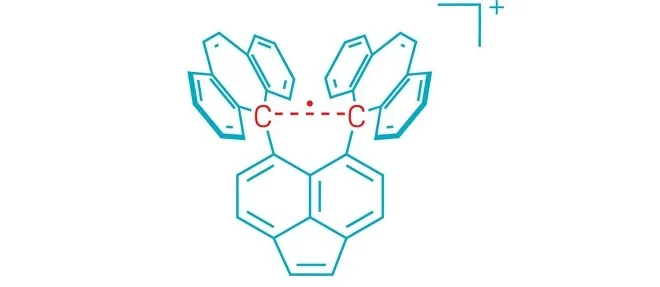
وتتكون أغلب الروابط الكيميائية في الجزيئات من زوج واحد من الإلكترونات، تتقاسمه الذرات. وتسمى هذه الروابط بالروابط التساهمية المفردة. وفي الروابط القوية بشكل خاص، قد تتقاسم الذرات زوجين من الإلكترونات في رابطة مزدوجة، أو ثلاثة أزواج ـ رابطة ثلاثية. ولكن الكيميائيين يعرفون أن الذرات تتفاعل بطرق أخرى عديدة، ومن خلال دراسة أنواع الروابط غير العادية على حدود الممكن، يأملون في فهم أفضل لماهية الرابطة الكيميائية في المقام الأول.
اقتراح باولينغ
يعود مفهوم الروابط التساهمية أحادية الإلكترون إلى عام 1931، عندما اقترحها الكيميائي البروفيسور لينوس بالولينغ. ولكن في ذلك الوقت، لم يكن لدى الكيميائيين الأدوات اللازمة لمراقبة مثل هذه الروابط، كما يقول البروفيسور مارك إتيان موريه [استاذ مشارك]، الكيميائي بجامعة أوتريخت في هولندا. وحتى مع التقنيات التحليلية الحديثة، فإن مراقبة هذه الروابط تشكل تحديًا. ويقول البروفيسور موريه: “الوضع الذي يشكل فيه إلكترون واحد فقط رابطة غير مستقر للغاية. وهذا يعني أن الرابطة سوف تنكسر بسهولة ولديها ميل قوي لإطلاق أو التقاط إلكترون لاستعادة عدد زوجي من الإلكترونات”.
وفي عام 1998، لاحظ العلماء[2] رابطة أحادية الإلكترون بين ذرتين من الفوسفور؛ وكان البروفيسور موريه جزءًا من مجموعة أنشأت[3] رابطة بين النحاس والبورون في عام 2013. وقد افترض الكيميائيون أن هذه الروابط غير العادية قد تحدث بين ذرات الكربون في هياكل وسيطة قصيرة العمر تظهر أثناء التفاعلات الكيميائية. ولكن لمراقبة هذه الروابط المتقلبة، يتعين على الكيميائيين تثبيت مركب يحتوي عليها. وقد كان من الصعب على الكيميائيين التوصل إلى مركب مستقر يحتوي على رابطة كربون-كربون (C–C) ذات إلكترون واحد.
ويقول البروفيسور شيماجيري إن مفتاح ملاحظة الرابطة الكربونية ذات الإلكترون الواحد كان تصميم جزيء بعناية يعمل على تثبيتها. وقد نجح فريق البحث، الذي ضم الكيميائي البروفيسور يوسوكي إيشيجاكي [استاذ مشارك] من جامعة هوكايدو اليابانية، في إنشاء جزيء يوفر “غلافًا” مستقرًا من حلقات الكربون المندمجة التي تساعد في تثبيت رابطة كربون-كربون في مركزها. وتمتد هذه الرابطة المركزية إلى طول طويل نسبيًا بالنسبة لرابطة كربون-كربون، مما يجعلها عرضة لفقدان إلكترون واحد في تفاعل الأكسدة، مما يخلق الرابطة الإلكترونية المفردة المراوغة.

رابطة مستقرة
لإمساك هذا المركب في شكل مستقر يمكن ملاحظته، قاموا ببلورته. وعندما تتم الأكسدة في وجود اليود، ينتج التفاعل ملحًا أرجوانيًا، مع غلاف مستقر للجزيء يحمل معًا رابطة كربون-كربون أحادية الإلكترون بالداخل. ثم استخدموا تقنيات تحليلية مختلفة لتوصيف الجزيء والرابطة. ويقول البروفيسور شيماجيري إن المركب مستقر للغاية في ظل الظروف المحيطة.
ويتابع البروفيسور شيماجيري: “في العديد من التفاعلات الكيميائية، تم اقتراح مشاركة روابط أحادية الإلكترون، ولكن حتى الآن، ظلت افتراضية”. إن إنشاء [تخليق] مركبات مستقرة تحتوي على هذه الروابط يمكن أن يساعد الباحثين على فهم أفضل لما يحدث أثناء هذه التفاعلات.
وكان البروفيسور غاي بيرتراند، الكيميائي في جامعة كاليفورنيا، في سانتا باربرا، جزءًا من الفريق الذي أنشأ رابطة الإلكترون المفردة للفوسفور. ويقول إنه من المهم رؤيتها في الكربون. ويضيف: “في أي وقت تفعل فيه شيئًا بالكربون، يكون التأثير أعظم من أي عنصر آخر”. والكربون هو مادة الكيمياء العضوية. ولكنه يقول [أي البروفيسور بيرتراند] إنه ليس من السهل أن نقول ما إذا كان هذا العمل سيكون له أي تطبيقات. ويقول: “هذا أمر مثير للفضول، لكنه سيكون في الكتب المدرسية”.
ويأمل البروفيسور شيماجيري أن يساعد وصف الرابطة الكربونية أحادية الإلكترون الكيميائيين على فهم الطبيعة الأساسية للروابط الكيميائية بشكل أفضل. ويقول: “نهدف إلى توضيح ماهية الرابطة التساهمية – على وجه التحديد، عند أي نقطة تصبح الرابطة مؤهلة لتكون تساهمية، وعند أي نقطة لا تصبح كذلك؟”
*تمت الترجمة بتصرف
مراجع:
- Shimajiri, T. et al. Nature https://doi.org/10.1038/s41586-024-07965-1 (2024).
- Canac, Y. et al. Science 279, 2080–2082 (1998).
- Moret, M.-E. et al. J. Am. Chem. Soc. 135, 3792–3795 (2013).
المصدر:
https://www.nature.com/articles/d41586-024-03138-2

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية