Japan’s Alpha Particle Assassin: New Treatment for Multiple Types of Cancer
(By RIKEN – بواسطة: معهد رايكين الياباني)
ملخص المقالة:
طور علماء معهد رايكين الياباني تقنية تعالج أنواعًا مختلفة من السرطان عن طريق إحداث إشعاع ألفا داخل الخلايا السرطانية، وقتلها مع ترك الأنسجة السليمة دون أن تصاب بأذى. وقد تم اختبار هذه التقنية على الفئران، حيث قللت بشكل كبير من نمو الورم وحققت معدل بقاء بنسبة 100 ٪. والخطوة التالية هي البدء في التجارب السريرية باستخدام هذه الطريقة الجديدة لعلاج السرطان لدى البشر.
( المقالة )
طور باحثون بقيادة البروفيسور كاتسونوري تاناكا في مجموعة رايكين للأبحاث الرائدة (CPR) في اليابان وهيروميتسو هابا في مركز “رايكين نيشينا” (RIKEN Nishina) للعلوم المعتمدة على التسريع (RNC) تقنية جديدة لديها القدرة على علاج عدة أنواع من السرطان بشكل عام، مع آثار جانبية سلبية أقل من الطرق المتاحة حاليًا.
ونشرت في 27 يونيو في مجلة العلوم الكيميائية (Chemical Science)، حيث أظهرت “دراسة إثبات المفهوم” أن الأورام في الفئران نمت أقل بثلاث مرات تقريبًا وأن البقاء على قيد الحياة كان 100 ٪ بعد حقنة واحدة فقط من مركب مصمم لإصدار كميات صغيرة من إشعاع ألفا من داخل الخلايا السرطانية، وبالتالي قتلها مع الحفاظ على الأنسجة السليمة.
وتوجد بعض العلاجات المستهدفة، لكن لا يمكن تطبيقها على جميع أنواع السرطان. ويقول البروفيسور تاناكا: “تتمثل إحدى أعظم مزايا طريقتنا الجديدة في أنه يمكن استخدامها لعلاج العديد من أنواع السرطان دون أي نواقل (متجهات) مستهدفة، مثل الأجسام المضادة أو الببتيدات”.
وتعتمد التقنية الجديدة على الكيمياء الأساسية وحقيقة أن مركبًا يسمى الأكرولين يتراكم في الخلايا السرطانية. وقبل بضع سنوات، استخدم فريق البروفيسور تاناكا أسلوبًا مشابهًا لاكتشاف خلايا سرطان الثدي الفردية. وقد ربطوا مركبًا فلوريًا بنوع معين من الأزيد – وهو جزيء عضوي به مجموعة من ثلاث ذرات نيتروجين في نهايته. وعندما يلتقي أزيد والأكرولين داخل خلية سرطانية، يتفاعلان، ويصبح المركب الفلوري راسخًا في الهياكل الموجودة داخل الخلية السرطانية. ونظرًا لأن مادة الأكرولين تكاد تكون غائبة عن الخلايا السليمة، فقد عملت هذه التقنية كمجس لإضاءة الخلايا السرطانية في الجسم.
وفي الدراسة الجديدة، بدلًا من مجرد اكتشاف الخلايا السرطانية، استهدف الفريق تلك الخلايا لتدميرها. وكان المنطق بسيطًا إلى حد ما. فبدلاً من ربط “الأزيد” بمركب فلورسنت، قاموا بربطه بشيء يمكن أن يقتل خلية دون الإضرار بالخلايا المحيطة. وقد اختاروا العمل مع “أستاتين-211″، وهو النويدات المشعة التي تصدر كمية صغيرة من الإشعاع على شكل جسيم ألفا عندما يتحلل.
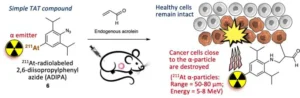
وبمجرد أن اكتشف الفريق أفضل طريقة لربط “أستاتين-211” بمجس “أزيد”، تمكنوا من إجراء تجربة إثبات المفهوم لاختبار نظريتهم. وقاموا بزرع خلايا ورم رئوي بشري في الفئران واختبروا العلاج تحت ثلاثة شروط: ببساطة حقن “الأستاتين-211” في الورم، وحقن مجس “أستاتين-211 أزيد” في الورم، وحقن مجس “أستاتين-211 أزيد” في مجرى الدم. ووجدوا أنه بدون استهداف، استمرت الأورام في النمو، ولم تنجو الفئران. وكما هو متوقع، عندما تم استخدام مجس أزيد، نمت الأورام أقل بثلاث مرات تقريبًا ونجت العديد من الفئران – 100 ٪ عندما تم حقنها في الورم و 80 ٪ عند حقنها في الدم.
ويقول البروفيسور تاناكا: “وجدنا أن حقنة واحدة فقط للورم مع 70 كيلو ’بيكريل’[4] من النشاط الإشعاعي كانت فعالة للغاية في استهداف الخلايا السرطانية والقضاء عليها”. ويتابع: “حتى عند حقن مركب العلاج في مجرى الدم، تمكنا من تحقيق نتائج مماثلة. هذا يعني أنه يمكننا استخدام هذه الطريقة لعلاج السرطان في مراحله المبكرة جدًا حتى لو كنا لا نعرف مكان الورم”.
يتم بالفعل اختبار نسخة مجس الفلوريسنت من هذه التقنية في التجارب السريرية كوسيلة لتصور / تشخيص السرطان على المستوى الخلوي. والخطوة التالية هي العثور على شريك والبدء في التجارب السريرية باستخدام هذه الطريقة الجديدة لعلاج السرطان لدى البشر.
*تمت الترجمة بتصرف
المرجع: “Therapeutic efficacy of 211At-radiolabeled 2,6-diisopropylphenyl azide in mouse models of human lung cancer” by Yudai Ode, Ambara R. Pradipta, Peni Ahmadi, Akihiro Ishiwata, Akiko Nakamura, Yasuko Egawa, Yuriko Kusakari, Kyohei Muguruma, Yang Wang, Xiaojie Yin, Nozomi Sato, Hiromitsu Haba and Katsunori Tanaka, 27 June 2023, Chemical Science. DOI: 10.1039/D3SC02513F
المصدر:
الهوامش:
[1] الأكرولين (Acrolein) (الاسم المنهجي: بروبينال “propenal”) هو أبسط ألدهيد غير مشبع. وهو سائل عديم اللون إلى أصفر شاحب ذو رائحة قوية ونفاذة هي رائحة الدهون المحترقة (كما هو الحال عند تسخين زيت الطهي إلى درجة احتراقه) ناتجة عن الجلسرين الموجود في الدهون المحترقة الذي يتحلل إلى مادة الأكرولين. يتم إنتاجه صناعياً من البروبين ويستخدم بشكل أساسي كمبيد حيوي ولبنة بناء لمركبات كيميائية أخرى، مثل ميثيونين الأحماض الأمينية. يستخدم الأكرولين بشكل أساسي كمبيد بيولوجي لمكافحة النباتات والطحالب والرخويات والفطريات والقوارض والكائنات الحية الدقيقة. كما تم استخدام الأكرولين في تصنيع مواد كيميائية أخرى، كعامل تحذير في الغازات، وكغاز اختبار للأقنعة الغازية، وفي الغازات السامة العسكرية، وفي تصنيع المعادن الغروية، ودباغة الجلود، وكمثبت في الأنسجة. المصدر: ويكيبيديا و https://www.epa.gov/radiation/radionuclides
[2] يتمتع استاتين-211 (Astatine-211 (211At)) بخصائص فيزيائية تجعله أحد أفضل المرشحين لاستخدامه كمصدر إشعاع للعلاج بالنويدات المشعة القائمة على جسيمات ألفا، ويشار إليه أيضًا باسم العلاج ألفا الموجه (TAT). تسمى الأشكال المشعة من العناصر بالنويدات المشعة. يحدث بعضها بشكل طبيعي في البيئة، في حين أن البعض الآخر من صنع الإنسان، إما عن عمد أو كمنتجات ثانوية للتفاعلات النووية. الراديوم -226 والسيزيوم -137 والسترونتيوم -90 هي أمثلة على النويدات المشعة. يحدث بعضها بشكل طبيعي في البيئة، في حين أن البعض الآخر من صنع الإنسان، إما عن عمد أو كمنتجات ثانوية للتفاعلات النووية. تم تصنيع الأستاتين لأول مرة في جامعة كاليفورنيا، بيركلي في عام 1940، ونُشر أول تقرير عن علاجه على البشر في وقت مبكر يعود إلى عام 1954. ولأن الأستاتين يفتقر إلى النظائر المستقرة أو طويلة العمر، فقد سمي على اسم الكلمة اليونانية القديمة “أستاتوس” بمعنى “غير مستقر”. المصدر: https://www.epa.gov/radiation/radionuclides & https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9859440
[3] في الكيمياء، أزيد (Azides) هو أنيون خطي متعدد الذرات مع الصيغة N − 3 وهيكل −N = N + = N−. إنها القاعدة المترافقة لحمض الهيدرازويك (HN3). الأزيدات العضوية هي مركبات عضوية لها الصيغة (RN3)، وتحتوي على مجموعة أزيد الوظيفية. التطبيق السائد للأزيدات هو بمثابة دافع في الأكياس الهوائية. والأزيدات هي جزيئات غنية بالطاقة لها العديد من التطبيقات. يستخدم أزيد الصوديوم ، على سبيل المثال ، كمادة حافظة ومطفرة ومبيد حيوي وكاشف فحص. الأزيدات العضوية قادرة على تنوع كبير في التفاعلات العضوية وهي مكونات مهمة في تفاعل أزيد-ألكين. المصدر: ويكيبيديا & https://ehs.stanford.edu/reference/information-azide-compounds
[4] البيكريل هو وحدة النشاط الإشعاعي في النظام الدولي للوحدات (SI). يُعرَّف البيكريل الواحد بأنه نشاط كمية من المادة المشعة تتحلل فيها نواة واحدة في الثانية. تم تسمية بيكريل على اسم هنري بيكريل، الذي تقاسم جائزة نوبل في الفيزياء مع بيير وماري سكودوفسكا كوري في عام 1903 لعملهما في اكتشاف النشاط الإشعاعي. ويكيبيديا.

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية