التقانة النانوية (nanotechnology) هي العلم، الهندسة، والتكنولوجيا التي تتم على المستوى النانوي ( الصغروي) ، والذي يشمل المقاييس من 1 إلى 100 نانومتر. وتُعرف علوم النانو وتكنولوجيا النانو بأنها دراسة هذه الأشياء الصغيرة جداً وابتكار تطبيقاتٍ لها، ويمكن استخدامهما في فروع العلم الأخرى، مثل الكيمياء والأحياء والفيزياء وعلم المواد والهندسة.
كيف بدأت التقانة النانوية؟
بدأت الأفكار والمفاهيم المتعلقة بعلوم وتكنولوجيا النانو في مقابلة مع الفيزيائي ريتشارد فاينمان (Richard Feynman) بعنوان “هناك مُتسّع كافٍ في القاع”، وذلك في الجمعية الفيزيائية الأميريكية (American Physical Society) في معهد كاليفورنيا للتقانة. وقد كان ذلك في التاسع والعشرين من ديسمبر/كانون الأول عام 1959م، أي قبل مدة طويلة من استخدام مصطلح التقانة النانوية. وقد وضّح فاينمان في مناقشته، آليةً من شأنها أن تُساعد العلماء على التلاعب بالذرات والجزيئات المفردة والتحكم بها.

وبعد عَقْد من الزمن وضع البروفيسور نوريو تانيجوشي (Norio Taniguchi) مصطلح التقانة النانوية، وذلك في فترة استكشافه للمعالجة الآلية فائقة الدقة (Ultraprecision machining). ولم تظهر التقانة النانوية الحديثة إلا في عام 1981، وذلك مع تطوير مجهر المسح النفقي (Scanning tunneling microscope) القادر على رؤية الذرات المنفردة.
من الصعب تخيُّل مدى ضآلة التقانة النانوية، فالنانومتر هو جزء من مليار من المتر. وفيما يلي بعض الأمثلة التوضيحية:
يُظهر هذا الشكل ثلاثة أمثلة لتوضيح مقياس النانو، والتي توضح مدى صغر الأشياء التي تُقاس على المستوى النانوي.

“علم الصيدلة النانوي” (nanopharmacology) هو فرع حديث نسبيا في علم الصيدلة، يبحث هذا الفرع في تفاعل الطب النانوي (nanomedicine) مع الأنظمة الحيوية على المستوى النانوي”.
يهتم الطب النانوي بشكل متزايد بمختلف الناقلات النانوية المعدلة على السطح، مثل (dendrimers) التغصنات والجسيمات النانوية (nanoparticles) والمواد النانوية القائمة على الكربون (carbon-based nanomaterials) والمقترنات النانوية للأدوية البوليمرية ( polymer-drug nanoconjugates) , وما إلى ذلك، والتي لديها إمكانات علاجية هائلة عن طريق توصيل أدوية محددة مستهدفة، وذلك باستخدام السقالات النانوية (nano scaffolding) والحاويات النانوية (nano containers) , بسبب الخصائص الفيزيائية والكيميائية والبيولوجية المحددة لهذه المواد المرتبطة بنطاق حجمها النانوي.
الابتكارات والتطورات الحديثة في علم الأدوية النووية
يقوم العلماء حاليا بالتحقيق في العديد من الناقلات التكنولوجية المتوافقة حيويا والنانو للتطبيقات الدوائية والطبية الحيوية. كما يجري التحقيق في البنية النانوية الهندسية السطحية مثل التغصنات والأنابيب النانوية والجسيمات النانوية بهدف تطوير تركيبات صيدلانية فعالة ومتوافقة حيويا وغير سامة. سنناقش في الأقسام التالية التطبيقات الدوائية لمختلف الناقلات النانوية العادية، وكذلك الهندسية السطحية. فيما يلي ملخص للتطبيقات المختلفة لهذه الناقلات النانوية:
الأنابيب النانوية الكربونية (CNTs)
تعد الأنابيب النانوية الكربونية نقطة جذب حديثة في علم الصيدلة. هذه مواد فريدة قائمة على الكربون، وهي مصنوعة من صفائح رسومية رقيقة تتكون من حلقات بنزين مكثفة ملفوفة في أسطوانة مجوفة أنبوبية غير ملحومة. استخدمت الأنابيب النانوية الكربونية الوظيفية في استهداف الأدوية وتصويرها، وكذلك في التوصيل الفعال للجينات والحمض النووي. تتمتع الأنابيب النانوية الكربونية الوظيفية أيضا بالقدرة على توصيل الأدوية غير القابلة للذوبان في الماء مثل مشتقات التاكسول (باكليتاكسيل ودوسيتاكسيل). علاوة على ذلك، فإن الأنابيب النانوية الكربونية لديها القدرة على عبور الحواجز الحيوية المختلفة بسهولة والمرور عبر غشاء البلازما ودخول السيتوبلازم. تسمى هذه الخاصية من الأنابيب النانوية الكربونية أيضا آلية “nanoneedle”، والتي تنقل الإمكانات الفريدة والمثيرة للاهتمام لنقل جزيئات البضائع. الخصائص الفيزيائية والكيميائية الفذة للكونفدرالية لها إمكانات التطبيق في المجال الطبي الحيوي.
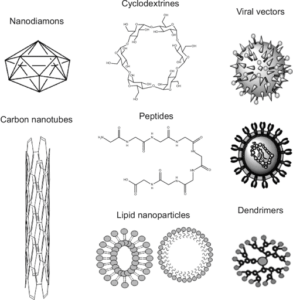
التغصنات (DENDRIMERS)
مصطلح “dendrimers” مشتق من الكلمة اليونانية “Dendron”، والتي تعني “شجرة”. . أظهرت أجهزة التغصن إمكانات هائلة في التسليم المتحكم فيه والمستهدف للعوامل العلاجية والتشخيصية. أظهرت التغصنات أيضا إمكاناتها كعوامل استهداف ورم معين وتصويره بدقة متناهية.
برزت التغصنات (Dendrimers) كنظام الناقلات النانوية الأكثر تنوعا في توصيل الأدوية الخاضعة للرقابة والمستهدفة. يوفر الفيلم المركب الهجين (dendrimer-nanoparticle) الإصدار المتحكم فيه للأسيكلوفير، والذي يمكن ضبطه بسهولة عن طريق تغيير توليد التغصنات وحجم الجسيمات النانوية. يتم استخدام التغصنات على نطاق واسع لاستهداف الورم لمختلف العوامل النشطة بيولوجيا والتصويرية. علاوة على ذلك، ظهرت التغصنات كعوامل ذوبان واعدة للأدوية سيئة الذوبان، كمركبات لتوصيل الأدوية داخل الخلايا، واستهداف هياكل محددة وبالتالي تحسين الفوائد العلاجية المحتملة.
الجسيمات النانوية
جسيمات النانو الدهنية الصلبة (SLNs) و (NLCs) ومتقارنات أدوية الدهون (LDCs) هي الإصدارات المعدلة من أنظمة توصيل الجسيمات النانوية، والتي تستند إلى مصفوفة الدهون الصلبة. يتم استكشاف أنظمة توصيل الجسيمات النانوية هذه لاستهداف الأدوية وإيصال الأنشطة الحيوية داخل الخلايا (الجينات والحمض النووي والأدوية). جسيمات (SLNs) مصنوعة من الدهون الصلبة وتتميز بخصائص مثل الاستقرار المادي والإفراج المتحكم فيه والتحمل الجيد وحماية الأدوية المحملة من التدهور. يتراوح قطر الجسيمات النانوية البوليمرية (PNPs) من 10 إلى 100 نانومتر، ويتم تصنيعها بشكل عام من البوليمرات (الطبيعية والاصطناعية).
علم السموم النانوية، قيود علم الأدوية النانوية
زاد تطبيق تكنولوجيا النانو من تعرض الإنسان للجسيمات النانوية عن طريق الابتلاع والامتصاص الجلدي والابتلاع واستنشاق المواد النانوية.
ولّد هذا المجال تخصصا علميا آخر في تكنولوجيا النانو، يسمى علم السموم النانوية، والذي يتعامل مع تقييم سلامة المواد النانوية.
قد يؤدي استنشاق الجسيمات ذات الحجم النانوي إلى ترسب واسع الانتشار لهذه المادة في جميع أجزاء الجهاز التنفسي بوساطة الانتشار. علاوة على ذلك، قد تدخل الجسيمات الصغيرة الحجم في الدورة الدموية الجهازية وقد تصل إلى الأعضاء الحساسة للغاية مثل الدماغ والقلب ونخاع العظام والطحال والغدد الليمفاوية عن طريق الامتصاص الخلوي وكثرة الخلايا عبر طبقات الخلايا الظهارية والبطانية. المساحة السطحية الكبيرة للمواد النانوية تجعلها أكثر فعالية بيولوجياً مقارنة بالجسيمات كبيرة الحجم التي لها نفس الخصائص الفيزيائية والكيميائية. على الرغم من أن التطور الأخير في تكنولوجيا النانو يقدم فوائد محتملة في مختلف المجالات بما في ذلك توصيل الأدوية، إلا أن سلامة هذه المواد النانوية هي جانب حاسم فيما يتعلق بصحة الإنسان وحماية البيئة. تظهر واحدة من الناقلات النانوية الأكثر تقدما، إمكانات واعدة في علم الصيدلة النانوية، ولكن العديد من الدراسات ذكرت أنها قد تسبب الالتهاب والتليف إذا وصلت إلى الرئتين. وبالتالي، من الضروري النظر في إمكانات وسلامة هذه المواد النانوية.
أنظمة توصيل الجسيمات النانوية
كبسولات النانو هي أنظمة حويصلية يقتصر فيها الدواء على تجويف محاط بغشاء بوليمر، في حين أن المواد النانوسفيرية هي أنظمة مصفوفة ينتشر فيها الدواء جسديا وموحدا. الجسيمات النانوية هي جسيمات صلبة غروانية تتكون من مواد جزيئية كبيرة تختلف في الحجم من 10 نانومتر إلى 1000 نانومتر. ومع ذلك، لا تتم متابعة الجسيمات >200 بشكل كبير وغالبا ما يشير الطب النانوي إلى الأجهزة <200 نانومتر (أي عرض الشعيرات الدموية الدقيقة).
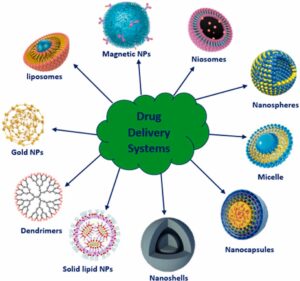
أهم مزايا استخدام الجسيمات النانوية لتوصيل الأدوية هي نتيجة لخاصيتين أساسيتين رئيسيتين: صغر الحجم واستخدام المواد القابلة للتحلل الحيوي.
يمكن للجسيمات النانوية، بسبب صغر حجمها، أن تنتشر من خلال البطانة في المواقع الالتهابية والظهارة (مثل: الأمعاء والكبد) والأورام أو تخترق الشعيرات الدموية الدقيقة. بشكل عام، يسمح الحجم النانوي لهذه الجسيمات بالامتصاص الفعال من قبل مجموعة متنوعة من أنواع الخلايا وتراكم الأدوية الانتقائي في المواقع المستهدفة. أظهرت العديد من الدراسات أن الجسيمات النانوية لها عدد من المزايا على الجسيمات الدقيقة (>1μm) كنظام لتوصيل الأدوية. تتمتع الجسيمات النانوية بميزة أخرى على الجسيمات الدقيقة الأكبر لأنها أكثر ملاءمة للتسليم عن طريق الوريد. أصغر الشعيرات الدموية في الجسم يبلغ قطرها 5-6μm. يجب أن يكون حجم الجسيمات التي يتم توزيعها في مجرى الدم أصغر بكثير من 5 ميكرون، دون تشكيل مجاميع لضمان عدم تسبب الجسيمات انسدادا. يسمح استخدام المواد القابلة للتحلل الحيوي لإعداد جسيمات النانو بإطلاق الدواء بشكل مستدام داخل الموقع المستهدف على مدى أيام أو حتى أسابيع.
نظام توصيل الأدوية المستهدف
الهدف من نظام توصيل الأدوية المستهدف هو إطالة أمد تفاعل الدواء مع الأنسجة المريضة وتوطينه واستهدافه وحمايته. نظام توصيل الدواء التقليدي هو امتصاص الدواء عبر غشاء بيولوجي، في حين أن نظام الإطلاق المستهدف يطلق الدواء في أشكال جرعات. تتمثل مزايا نظام الإطلاق المستهدف في تقليل تواتر الجرعات التي يتناولها المريض، ولها تأثير أكثر اتساقا للدواء، والحد من الآثار الجانبية للدواء، وتقليل التقلبات في مستويات الدواء المتداولة. عيب النظام هو التكلفة العالية، مما يجعل الإنتاجية أكثر صعوبة وانخفاض القدرة على ضبط الجرعات.
الاستهداف السلبي
في الاستهداف السلبي، يرتبط نجاح الدواء مباشرة بوقت الدورة الدموية. يتحقق ذلك عن طريق إخفاء الجسيمات النانوية بنوع من الطلاء. يمكن للعديد من المواد تحقيق ذلك، إحداها البولي إيثيلين جلايكول (PEG). بإضافة ربط إلى سطح الجسيمات النانوية، يصبح محبا للماء، مما يسمح لجزيئات الماء بالارتباط بجزيئات الأكسجين على الربط عن طريق الترابط الهيدروجيني.
الاستهداف النشط
يعزز الاستهداف النشط للجسيمات النانوية المحملة بالأدوية آثار الاستهداف السلبي لجعل الجسيمات النانوية أكثر تحديدا للموقع المستهدف. هناك عدة طرق يمكن من خلالها تحقيق الاستهداف النشط. تتمثل إحدى الطرق لاستهداف الأنسجة المريضة فقط في الجسم بنشاط في معرفة طبيعة المستقبلات على الخلية التي سيستهدف بها الدواء.
نظام توصيل الأدوية بجسيمات الدهون
أحدث مفهوم نظام توصيل الأدوية الشحمية ثورة في مجال المستحضرات الصيدلانية. منذ ذلك الحين، تم إجراء أبحاث نشطة في مجال الجسيمات الشحمية وأصبحت تطبيقاتها الآن راسخة في مجالات مختلفة، مثل الأدوية والجزيئات الحيوية وإيصال الجينات. الجسيمات الشحمية هي حويصلات كروية تتميز بطبقة ثنائية من الدهون مع تجويف مائي داخلي. المكونات الهيكلية للدهون هي الدهون الفوسفورية أو البرمائيات الاصطناعية المدمجة مع الستيرول، مثل الكوليسترول، للتأثير على نفاذية الغشاء.
يمكن استخدام جزيئات الذهب عند وضع علامة عليها بشرائح قصيرة من الحمض النووي للكشف عن التسلسل الجيني بطريقة بسيطة. بمساعدة تكنولوجيا النانو، يمكن إعادة إنتاج الأنسجة التالفة أو إصلاحها. تستخدم هذه الخلايا المحفزة صناعيا في هندسة الأنسجة، مما قد يحدث ثورة في زرع الأعضاء أو الزرع الاصطناعي.
شكلان من أشكال طب النانو التي تم اختبارها بالفعل على الفئران وتنتظر التجارب البشرية:
استخدام قذائف النانو الذهبية للمساعدة في تشخيص السرطان وعلاجه، واستخدام الجسيم الشحمي كمساعد لقاح وكمركبات لنقل الأدوية. وبالمثل، فإن إزالة السموم من الأدوية هي أيضا تطبيق آخر للطب النانوي الذي تم استخدامه بنجاح في الفئران.
تكنولوجيا النانو في علاج الاضطرابات التنكسية العصبية
مرض باركنسون:
يمكن أن يحسن العلاج الحالي لمرض باركنسون (PD) وهو ثاني أكثر الأمراض التنكسية العصبية شيوعا بعد مرض الزهايمر ويؤثر على واحد من كل 100 شخص فوق سن 65 عاما. تهدف العلاجات الحالية إلى تحسين القدرة الوظيفية للمريض لأطول فترة ممكنة ولكن لا يمكنها تعديل تقدم العملية التنكسية العصبية. الهدف من تكنولوجيا النانو التطبيقية هو التجديد والحماية العصبية للجهاز العصبي المركزي (CNS) وستستفيد بشكل كبير من أبحاث تكنولوجيا النانو الأساسية التي أجريت بالتوازي مع التقدم في الفيزيولوجيا العصبية وعلم الأمراض العصبية وبيولوجيا الخلايا. يتم بذل الجهود لتطوير تقنيات جديدة تساعد بشكل مباشر أو غير مباشر في توفير الحماية العصبية والبيئة المتساهلة والإشارات النشطة لنمو المحور العصبي الموجه. من أجل تقليل الآثار الجانبية الطرفية للأشكال التقليدية لعلاج مرض باركنسون، تركز الأبحاث على تصميم جهاز سقالة نانوي داخل الجمجمة وتحفيزه وتحسينه (NESD) لتوصيل الدوبامين الخاص بالموقع إلى الدماغ، كاستراتيجية.
مرض الزهايمر:
في جميع أنحاء العالم، يتأثر أكثر من 35 مليون شخص بمرض الزهايمر (AD)، وهو الشكل الأكثر شيوعا للخرف. تجد تقنية النانو تطبيقات مهمة في علم الأعصاب. تستند هذه الأساليب إلى التشخيص المبكر لمرض الزهايمر والعلاج الذي أصبح ممكنا من خلال تصميم وهندسة عدد كبير من كيانات الجسيمات النانوية ذات الخصوصية العالية للخلايا البطانية الشعرية في الدماغ. الجسيمات النانوية (NPs) لها تقارب كبير لأشكال الأميلويد-β المتداولة (Aβ) وبالتالي قد تحفز “تأثير الحوض” وتحسن حالة مرض الزهايمر.

توصيل وعلاج أدوية جسيمات النانو في علاج السرطان
واحدة من الوفيات الرابعة في الولايات المتحدة هي بسبب السرطان. يتم تشخيص حوالي 1.2 مليون أمريكي بالسرطان سنويا ويموت أكثر من 500000 شخص. علامات الورم هي توقيع الخلايا السرطانية والجسيمات النانوية الحديثة التي تم تطويرها للإقتران بعلامات جزيئية مختلفة. علامة الورم هي مادة موجودة في أنسجة الجسم لا يمكن رفعها إلا في الخلايا السرطانية. دوكسوروبيسين (DOX) هو أكثر الأدوية المضادة للسرطان كفاءة، ولكنه يمكن أن يسبب موت الخلايا السليمة أيضا. لهذا السبب يمكن للكبسولة النانوية توصيل (DOX) فقط داخل الخلايا السرطانية باستخدام توقيع علامات (oncomarkers). يتكون من قشرة الحمض النووي والأوريغامي المغطاة بعوامل مناعية مع مواقع ربط الجزيئات على سطحه. يبدأ تسليم الجسيمات النانوية من مجرى الدم. تخترق جسيمات (DOX) النانوية داخل الخلية السرطانية بسبب علامات السرطان على سطحها. عندما تقترن كبسولات النانو مع عدة علامات، تفتح قذائف الحمض النووي أوريغامي التي تطلق (DOX) داخل الخلية. تم تسليم (DOX) بنجاح. تموت الخلايا السرطانية بسبب دوكس مباشرة.
يستخدم نظام توصيل أدوية الخلايا الصغيرة جرعة أقل من الدواء وله آثار جانبية أقل يمكن استخدامها لعلاج عدد من أنواع السرطان المختلفة بأدوية مختلفة مضادة للسرطان.
التطبيقات في طب العيون:
تشمل بعض تطبيقات تكنولوجيا النانو على طب العيون علاج الإجهاد التأكسدي؛ وقياس ضغط العين؛ واستخدام جزيئات النانو لعلاج الأوعية المشيمية الجديدة، ومنع الندوب بعد جراحة الجلوكوما، وعلاج الأمراض التنكسية الشبكية باستخدام العلاج الجيني؛ والأطراف الاصطناعية وطب النانو المتجدد.
التطبيقات في طب الأسنان الجراحي:
تهدف تقنية النانو إلى إنشاء واستخدام المواد والأجهزة على المستوى الذري والجزيئي، والهياكل فوق الجزيئية وفي استغلال الخصائص الفريدة للجسيمات ذات الحجم 0.1 نانومتر إلى 100 نانومتر. يعتقد أن مواد الراتنج المركبة المملوءة بالنانو توفر مقاومة ممتازة للتآكل وقوة وجماليات نهائية بسبب قابليتها للتلميع الاستثنائي والاحتفاظ باللمعان. في طب الأسنان الجراحي، تشكل الحشوات النانوية جزيئات ثاني أكسيد السيليكون الكروية (SiO2) بمتوسط حجم 5-40 نانومتر. المركبات الهجينة الصغيرة مع حمولة إضافية من حشوات النانو هي الخيار الأفضل في طب الأسنان الجراحي.
الخلاصة
أدى البحث المتواصل عن استراتيجيات علاجات جديدة واعدة إلى زيادة الاستكشاف الدوائي لتكنولوجيا النانو، مما أدى إلى تقدم الطب النانوي. يعتمد نجاح علم الصيدلة النانوية على تصميم التركيبات، والتي يمكنها التغلب على الحواجز الفسيولوجية لتحقيق نتائج علاجية. على الرغم من أنه ليس لدينا في الوقت الحاضر سوى نظرة سطحية لعلم الصيدلة النانوية، إلا أنه سيوفر فرص واعدة للمراقبة الدقيقة والتحكم الدقيق لآلية عمل الأدوية لعلاج الأمراض.
*غسان علي بوخمسين ، صيدلاني أول ، مستشفى جونز هوبكنز.
 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية
