Scientists ‘Blown Away’ by New Treatment Restoring Sight to Blind Mice
(CARLY CASSELLA – بقلم: كارلي كاسيلّا)
ملخص المقالة:
قدرة الدماغ على التكيف وإعادة توصيل نفسه طوال الحياة لا تزال تفاجئ علماء الأعصاب. فقد وجد الباحثون طريقة لاستعادة البصر لدى الفئران البالغة المصابة بداء “ليبر” الخلقي الناتج عن اضطراب بشري نادر في شبكية العين يسبب العمى أو ضعف البصر الشديد عند الولادة، على الرغم من النضج النسبي للقوارض. وأظهرت دراسات سابقة أجريت على أطفال مصابين بهذا الداء أن علاجات الريتينويد الاصطناعية يمكن أن تساعد في تعويض بعض فقدان البصر عند حقنها مباشرة في العين. وقد نجح العلاج في نهاية المطاف في استعادة حساسية الضوء لدى الحيوانات جزئيًا وسلوكياتها النموذجية في توجيه الضوء لمدة 27 يومًا. وبعد تسعة أيام من العلاج، تم تنشيط عدد أكبر بكثير من الخلايا العصبية في القشرة البصرية بواسطة العصب البصري. وهناك حاجة إلى مزيد من البحث على النماذج الحيوانية؛ وربما يمكن لعلماء الأعصاب في يوم من الأيام اختبار ما إذا كان يمكن تحفيز فوائد مماثلة لدى كبار السن من البشر ممن يعانون من بعض إصدارات عيب “ليبر” الخلقي.
( المقالة )
لا تزال قدرة الدماغ على التكيف وإعادة توصيل نفسه طوال الحياة تفاجئ علماء الأعصاب. فقد وجد الباحثون طريقة لاستعادة البصر لدى الفئران البالغة المصابة بشكل من أشكال العمى الخلقي، على الرغم من النضج النسبي للقوارض.
وكانت الفئران تشكل نموذجًا لاضطراب بشري نادر في شبكية العين، يُسمى داء [عيب] “ليبر” الخلقي[1 ، 2] (Leber congenital amaurosis (LCA)) ، والذي غالبًا ما يسبب العمى أو ضعف البصر الشديد عند الولادة. ويبدو أن هذه الحالة الموروثة ناتجة عن طفرة في أي واحد من عشرات الجينات المرتبطة بشبكية العين وقدراتها على استشعار الضوء.
ويعمل الباحثون على علاجات يمكنها استعادة المستقبلات الضوئية التالفة أو المختلة وظيفيًا في هذا الجزء من العين لعدة عقود. وتتضمن بعض الاستراتيجيات زرع الشبكية وتدخلات تعديل الجينات والعلاجات الدوائية.
وتعزز هذه العلاجات الناشئة الرؤية بمستويات متفاوتة من النجاح، لكن المركبات الاصطناعية التي تستهدف الشبكية تبدو واعدة بشكل خاص لأولئك الذين لديهم طفرات تتضمن مستقبلات ضوئية للقضيب[3].
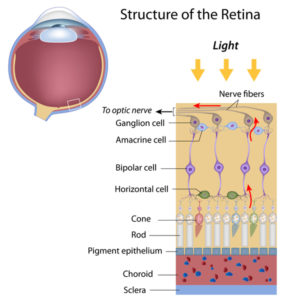
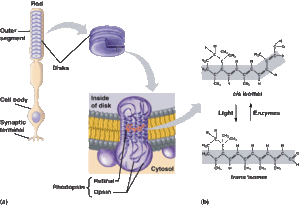
والقضبان (جمع قضيب) هي المستقبلات الضوئية الموجودة في الجزء الخلفي من العين والتي تستشعر الضوء الخافت. وتستخدم هذه الخلايا العصبية المتخصصة سلسلة من التفاعلات الكيميائية الحيوية لتحويل الضوء الحسي إلى إشارات كهربائية ليقرأها باقي الدماغ.
ونظرًا لأن الأصباغ الحساسة للضوء في قضبان الشبكية تمتص مستويات منخفضة من الضوء، فإنها تحول جزيء الشبكية[4] (11-cis retinal) إلى عابر شبكي شامل، والتي بدورها تولد نبضة تنتقل عبر العصب البصري إلى الدماغ.
وقد أظهرت الدراسات السابقة التي أجريت على الأطفال المصابين بعيب “ليبر” الخلقي أن علاجات الريتينويد[5] الاصطناعية يمكن أن تساعد في تعويض بعض فقدان البصر عند حقنها مباشرة في العين. ولكن كيفية تأثير هذه العلاجات على البالغين المصابين بهذه الحالة ليست مفهومة جيدًا.
وكتب الباحثون: “على الرغم من إحراز بعض التقدم، لا يزال من غير الواضح إلى أي مدى يمكن استعادة الدوائر البصرية للبالغين إلى حالة وظيفية كاملة على مستوى القشرة البصرية عند تصحيح عيب الشبكية”.
تقليديًا، يُعتقد أن النظام البصري للدماغ يتشكل ويتقوى خلال فترات نمو معينة في الحياة المبكرة. وإذا لم يتم تدريب العين خلال هذه الفترات الحرجة، فقد لا يتم أبدا توصيل الشبكات البصرية في الدماغ بشكل صحيح للبصر، مما يؤدي إلى عجز في الرؤية مدى الحياة.
ولكن قد لا تكون إمكانات الرؤية لدى الثدييات متماسكة بشكل صارم؛ يمكن أن تكون بلاستيكية (غير مرنة) أكثر بكثير مما هو مفترض. ولاستكشاف هذه الفكرة، قام الباحثون بإعطاء ريتينويد اصطناعي لمدة سبعة أيام للقوارض البالغة المولودة مع تنكس الشبكية.
وقد نجح العلاج في نهاية المطاف في استعادة حساسية الضوء لدى الحيوانات جزئيًا وسلوكياتها النموذجية في توجيه الضوء لمدة 27 يومًا. وبعد تسعة أيام من العلاج، تم تنشيط عدد أكبر بكثير من الخلايا العصبية في القشرة البصرية بواسطة العصب البصري. ويشير هذا إلى أن المسار البصري المركزي الذي ينقل المعلومات من العين إلى القشرة البصرية يمكن استعادته بشكل كبير عن طريق العلاج بالريتينويد، حتى في الفئران البالغة.
ويقول عالم الأعصاب البروفيسور [أستاذ مشارك] سونيل غاندي من جامعة كاليفورنيا في إيرفين: “بصراحة، لقد أُذْهِلنا بمقدار انقاذ العلاج دوائر الدماغ المرتبطة بالرؤية”.
ويتابع: “الرؤية تنطوي على أكثر من شبكية العين السليمة والعاملة. فهي تبدأ في العين، والتي ترسل إشارات في جميع أنحاء الدماغ. في الدوائر المركزية للدماغ ينشأ الإدراك البصري بالفعل”.
وقد أجريت الدراسة على الفئران فقط، لكن الاكتشاف جعل علماء الأعصاب يعتقدون أن النافذة الحاسمة للنظام البصري البشري قد تكون أيضًا أكبر مما كان يُفترض في السابق. وبعبارة أخرى، لا يعني الافتقار إلى الرؤية في مرحلة الطفولة بالضرورة أنه لا يمكن استعادة البصر في مرحلة البلوغ.
ويقول البروفيسور غاندي: “مباشرة بعد العلاج، قامت الإشارات القادمة من عين الجانب المعاكس، وهو المسار السائد في الفأر، بتنشيط خلايا عصبية مرتين أكثر في الدماغ”.
ويضيف: “ما كان أكثر اذهالًا للعقل هو أن الإشارات القادمة من مسار عين نفس الجانب نشطت خمسة أضعاف خلايا عصبية أكثر في الدماغ بعد العلاج وكان هذا التأثير المثير للإعجاب طويل الأمد”.
وهناك حاجة إلى مزيد من البحث على النماذج الحيوانية. ولكن ربما في يوم من الأيام، يمكن لعلماء الأعصاب اختبار ما إذا كان يمكن تحفيز فوائد مماثلة لدى كبار السن من البشر يعانون من بعض إصدارات عيب “ليبر” الخلقي.
ويوضح البروفيسور غاندي: “حقيقة أن هذا العلاج يعمل جيدًا في المسار البصري المركزي في مرحلة البلوغ يدعم مفهومًا جديدًا، وهو أن هناك إمكانية كامنة للرؤية تنتظر فقط أن يتم تشغيلها”.
ملحوظة: نُشرت الدراسة في مجلة “علم الأحياء الحالي” (Current Biology).
*تمت الترجمة بتصرف
المصدر:
https://www.sciencealert.com/scientists-blown-away-by-new-treatment-restoring-sight-to-blind-mice
الهوامش:
- تيودور كارل غوستاف فون ليبر (29 فبراير 1840 – 17 أبريل 1917) هو طبيب عيون ألماني من كارلسروه. وكان طالبًا لدى هيرمان فون هيلمهولتز (1821-1894) في هايدلبرغ، حيث حصل على الدكتوراه في عام 1862. وظل في هايدلبرغ كمساعد لهيرمان جاكوب كناب (1832-1911) في عيادة هايدلبرغ للعيون، وبعد ذلك درس علم وظائف الأعضاء على يد كارل لودفيج (1816-1895) في فيينا. ومن عام 1867 حتى عام 1870 كان مساعدًا لطبيب العيون ألبريشت فون جريف (1828-1870) في برلين. وفي عام 1871، أصبح مديرًا لعيادة العيون الجامعية في جوتنجن، ومن عام 1890 إلى عام 1910 كان مديرًا لعيادة العيون في هايدلبرغ. الدكتور ليبر هو أول من وصف ما يُعرف الآن باسم مرض ليبر الخلقي في عام 1869 واعتلال ليبر العصبي البصري الوراثي في عام 1871. وتمت تسمية بنية تشريحية تسمى “ضفيرة ليبر” باسمه، وهي عبارة عن ضفيرة وريدية صغيرة في العين تقع بين قناة شليم (سميت على اسم عالم التشريح الألماني فريدريش شليم) ومساحات فونتانا (سميت على اسم الفيزيائي الإيطالي فيليس فونتانا). وتقدم الجمعية الألمانية منحة لطب العيون باسم ليبر، وتسمى منحة تيودور ليبر لتعزيز البحوث الدوائية والفسيولوجية الدوائية في طب العيون. ويكيبيديا
- داء ليبر الخلقي (Leber Congenital Amaurosis)، المعروف أيضًا باسم (LCA) هو اضطراب خلقي في العين موجود منذ الولادة، يؤثر في المقام الأول على شبكية العين، وهي النسيج المتخصص في الجزء الخلفي من العين الذي يكتشف الضوء واللون. عادةً ما يعاني الأشخاص المصابون بهذا الاضطراب من ضعف شديد في البصر يبدأ عند الولادة أو بعد ذلك بوقت قصير. يميل ضعف البصر إلى أن يكون شديدًا وقد يتفاقم بمرور الوقت. ويرتبط مرض ليبر الخلقي أيضًا بمشاكل أخرى في الرؤية، بما في ذلك زيادة الحساسية للضوء (رهاب الضوء)، والحركات اللاإرادية للعيون (الرأرأة)، وطول النظر الشديد (مد البصر). ولا يتفاعل التلاميذ، الذين عادة ما يتمددون وينكمشون استجابة لكمية الضوء التي تدخل العين، بشكل طبيعي مع الضوء. بدلاً من ذلك، يتمددون وينكمشون بشكل أبطأ من المعتاد، أو قد لا يستجيبون للضوء على الإطلاق. وهناك سلوك محدد يسمى علامة فرانشيسكيتي الرقمية هو سمة من سمات مرض ليبر الخلقي. تتكون هذه العلامة من الأفراد المصابين بدس، وضغط، وفرك عيونهم بإصبع أو مفصل. غالبًا ما يؤدي ثقب أعينهم إلى الإحساس بوميض من الضوء يسمى الفوسفين. يعتقد الباحثون أن هذا السلوك قد يساهم في تعميق أعين الأطفال المصابين. وفي حالات نادرة جدًا، تم الإبلاغ عن تأخر في النمو وإعاقة ذهنية لدى الأشخاص الذين يعانون من داء ليبر الخلقي. بسبب فقدان البصر، قد يصبح الأطفال المصابون معزولين. قد يؤدي تزويد الأطفال بفرص اللعب والسمع واللمس والفهم والتدخلات التعليمية المبكرة الأخرى إلى منع حدوث تأخيرات في النمو لدى الأطفال المصابين بداء ليبر الخلقي. وقد تم وصف ما لا يقل عن 20 نوعًا وراثيًا من مرض ليبر الخلقي، وتتميز الأنواع بأسبابها الوراثية وأنماط فقدان الرؤية وما يرتبط بها من تشوهات في العين. المصدر: https://medlineplus.gov/genetics/condition/leber-congenital-amaurosis
- قضيب (Rod): خلية حساسة للضوء من أحد النوعين الموجودين بأعداد كبيرة في شبكية العين، وهي مسؤولة بشكل أساسي عن الرؤية أحادية اللون في الإضاءة الضعيفة.
- الجزيء الذي يتيح لنا الرؤية هو شبكية العين وهو مثير للاهتمام لأنها السبب في قدرتنا على الرؤية، أو واحد منهم على الأقل. شبكية العين (Retinal)، أو الأصح، (11-cis retinal)، هو جزيء صغير يلائم موقع الارتباط لبروتين كبير يسمى أوبسين (opsin). يشكلان معًا رودوبسين (rhodopsin) المعروف أيضًا باسم “الأرجواني المرئي”، الذي يظهر هيكله أدناه. ومن هنا تأتي المصطلحات “قضبان” (مثل رودوبسين) و “مخاريط”، في إشارة إلى الخلايا الموجودة في شبكية أعيننا التي تحتوي على أصباغ الرودوسين والأيزودوبوسين، على التوالي. للمزيد، راجع المصدر على الرابط: Retinal – Molecule of the Month – April 2009 – HTML-only version (bris.ac.uk)
- يشير مصطلح ريتينويد إلى مجموعة من المركبات المشتقة من فيتامين أ، وهذا يعني أنها تمتلك أوجه تشابه بنيوية أو وظيفية مع فيتامين أ. يمكن أن تكون الريتينويدات طبيعية أو صناعية وتشمل العديد من الأنواع والأشكال، مثل إسترات الريتينول والشبكية والريتينيل. والريتينويدات هي عنصر نشط شائع في العديد من الأدوية الجلدية ومستحضرات التجميل بسبب تأثيرها الإيجابي على الجلد ومظهره. الرتينويدات متوفرة في شكلين: موضعي وشفوي. وتشير الرتينويدات الموضعية إلى الكريمات والمواد الهلامية والسوائل التي يمكن للناس وضعها مباشرة على الجلد، بينما تحتوي الرتينويدات الفموية على أقراص وكبسولات يمكن للشخص تناولها عن طريق الفم. ويمكن شراء أشكال أضعف من الريتينويد للمساعدة في علاج حب الشباب الخفيف أو تقليل علامات الشيخوخة. ولا تتوفر الأشكال الأقوى إلا من خلال وصفة طبيب، وعادةً ما تعالج الحالات الجلدية الأكثر خطورة، مثل الصدفية. المصدر: https://www.medicalnewstoday.com/articles/retinoids#benefits

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية
