Computer simulations of proteins help unravel why chemotherapy resistance occurs
(Stony Brook University – بواسطة: جامعة ستوني بروك بولاية نيويورك)
ملخص المقالة:
توصل فريق من العلماء إلى عملية جديدة تحدث من خلالها مقاومة الأدوية، وذلك باستخدام نموذج محاكاة حاسوبي يساعدهم على فهم كيفية تفاعل الجزيئات بالضبط مع عقار السرطان ايماتينيب (يعالج سرطان الدم المزمن) في عملية مقاومة العلاج الكيميائي. ورغم أنه علاج فعال للغاية، الا أن العديد من مرضى المرحلة المتأخرة يعاني من مقاومة الأدوية، مما يجعل الدواء فعالًا إلى الحد الأدنى في تلك المرحلة. وتمكن الآثار المترتبة على ما اكتشفوه العلماء من فهم كيفية إطلاق العقاقير من بروتيناتهم، فقد يكونون قادرين على تصميم أدوية ذات إطلاق أبطأ وتأثير علاجي أعلى.
( المقالة )
يعد فهم سبب حدوث مقاومة العلاج الكيميائي وكيفية حدوثه خطوة رئيسية نحو تحسين علاجات السرطان. ويعتقد فريق من العلماء، بما في ذلك الدكتور ماركوس سيليغر من مركز ستوني بروك للسرطان وكلية رينيسانس للطب في جامعة ستوني بروك، أنهم توصلوا إلى عملية جديدة تحدث من خلالها مقاومة الأدوية.
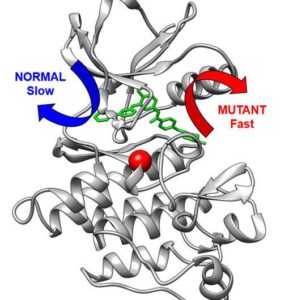
إنهم يستخدمون نموذج محاكاة حاسوبي يساعدهم على فهم كيفية تفاعل الجزيئات بالضبط مع عقار السرطان ايماتينيب (Imatinib) (المعروف باسم غليفيك Gleevec) في عملية مقاومة العلاج الكيميائي. يعالج ايماتينيب سرطان الدم النخاعي المزمن (Chronic Myeloid Leukemia – CML) بشكل فعال للغاية، ومع ذلك يعاني العديد من مرضى المرحلة المتأخرة من مقاومة الأدوية، مما يجعل الدواء فعالًا إلى الحد الأدنى في تلك المرحلة.
وتم تسليط الضوء على البحث في ورقة بحثية نُشرت في “أناغيواندت كيمي” (Angewandte Chemie) (مجلة الجمعية الكيميائية الالمانية) وهو يعتمد على البحث السابق المفصل في عام 2021 في نشرة “وقائع الأكاديمية الوطنية للعلوم” (Proceedings of the National Academy of Sciences – PNAS).
ويثبط ايماتينيب “كاينس بروتين ابل بي سي آر” (BCR-Abl) ، وهو عبارة عن آلة إشارات خلوية نشطة للغاية في سرطان الدم النخاعي المزمن. وفي دراسة “وقائع الأكاديمية الوطنية للعلوم”، أظهر الباحثون أن الاختلافات في خطة بناء الكاينس يمكن أن تجعل من الصعب على إيماتينيب الارتباط بـ “كاينس” وكذلك تسريع إطلاق الدواء منه. وفي ورقة مجلة الجمعية الكيميائية الالمانية، أخذ فريق البحث منهجية حسابية – طورها المؤلف المشارك براتييوش تيواري من جامعة ميريلاند – والتي مكنتهم من دراسة الإطلاق البطيء جدًا لـ ايماتينيب من “كاينس”.
“تعد هذه الطريقة بحد ذاتها إنجازًا تقنيًا كبيرًا يوسع القدرات الحسابية لأبحاث مقاومة الأدوية، وأدى بشكل مهم إلى قدرتنا على التنبؤ بمدى سرعة إطلاق البروتينات السليمة والمتحولة لهذا الدواء”، كما يقول البروفيسور سيليغر، أستاذ مشارك في قسم علم الأدوية. ويضيف: “لأول مرة، يمكننا أن نرى إطلاق دواء من بروتين بمثل هذه التفاصيل والدقة. علاوة على ذلك، يمكننا أن نظهر أن الطفرة تتغير بشكل أساسي في طريق خروج الدواء من البروتين”. ويتابع: “هذا مهم لأن سرعة إطلاق الدواء قد تكون بنفس أهمية التأثير العلاجي للدواء مثل مدى ارتباط الدواء بالبروتين”. ويوضح كذلك أن الطريقة يمكن أن توفر أساسًا لفهم الآليات الجزيئية وراء مقاومة العلاج الكيميائي.
وعلى نطاق أوسع، فإن الآثار المترتبة على ما اكتشفوه هي أنه إذا تمكن العلماء من فهم كيفية إطلاق العقاقير من بروتيناتهم، فقد يكونون قادرين على تصميم أدوية ذات إطلاق أبطأ وتأثير علاجي أعلى. وبالإضافة إلى ذلك، إذا كان الإفراج السريع عن الدواء يمكن أن يسبب مقاومة للأدوية، ويمكن للأطباء إثبات حدوث ذلك، فقد يكونون قادرين على إعادة تنشيط فعالية الدواء عن طريق مطالبة المريض بتناول الدواء بشكل متكرر.
وتم توضيح الأساس لإختبار الطفرة عبر الطريقة الحسابية في ورقة “وقائع الأكاديمية الوطنية للعلوم”. واختبر البروفيسور سيليغر وزملاؤه كيف يرتبط إيماتينيب بالطفرات في مرضى سرطان الدم النخاعي المزمن المقاوم للإيماتينيب. ووجدوا أن غالبية الطفرات ترتبط بسهولة بإيماتينيب، لذلك طرح هذا السؤال كيف تسبب هذه الطفرات مقاومة لدى المرضى؟ وقد حدد الباحثون بعد ذلك العديد من الطفرات التي تربط إيماتينيب بسهولة لكنها تطلق الدواء بشكل أسرع.
وبعد تحديد هذه الطفرات بإطلاق دوائي أسرع، استخدم الفريق الرنين المغناطيسي النووي (NMR) والديناميكيات الجزيئية لربط البروتين بتفكك الدواء – وهو ما يكمن وراء أهمية حركية تفكك الدواء لفعالية الدواء. وقد مكنهم ذلك من تحديد آلية جديدة لمقاومة إيماتينيب.
وتضمن العمل الناتج عن الورقة المنشورة في “وقائع الأكاديمية الوطنية للعلوم” جهودًا تعاونية من البروفيسور سيلينغر وزملائه في جامعة ستوني بروك، والباحثين في مركز ميموريال سلون كيترينج للسرطان وجامعة جوته في فرانكفورت، ألمانيا.
وقاد تيواري وزملاؤه في جامعة ماريلاند البحث الذي نتج عنه البحث الأحدث، بالتعاون مع البروفيسور سيليغر وعلماء في معهد برود في معهد ماساتشوستس للتكنولوجيا وجامعة هارفارد.
*تمت الترجمة بتصرف
المصدر:
https://phys.org/news/2022-06-simulations-proteins-unravel-chemotherapy-resistance.html
لمزيد من المعلومات:
مرينال شيخار وآخرون، Protein Flexibility and Dissociation Pathway Differentiation Can Explain Onset of Resistance Mutations in Kinases, Angewandte Chemie International Edition (2022). DOI: 10.1002/anie.202200983
أغاثا ليزسشيك وآخرون، Mutation in Abl kinase with altered drug-binding kinetics indicates a novel mechanism of imatinib resistance, Proceedings of the National Academy of Sciences (2021). DOI: 10.1073/pnas.2111451118

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية