Researchers reveal new molecular mechanism for Parkinson’s disease risk
(University of Michigan – بواسطة: جامعة ميشيغان)
ملخص المقالة:
اكتشف باحثو جامعة ميشيغان كيف يعمل بروتين متحور يسمى بروتين “عبر الغشاء 175” كعامل خطر في حوالي 20٪ من حالات مرض باركنسون الذي يعتقد أنه ناتج عن مجموعة من العوامل الوراثية والبيئية، وفي باركنسون تبدأ الخلايا العصبية في منطقة الدماغ التي تتحكم في الحركة بالفشل والموت. ووفقًا للمعهد الوطني للشيخوخة. وقد وجدوا أنه إذا تم التحور، فإن بروتين عبر الغشاء 175 لا ينظم بشكل صحيح حموضة البيئة داخل الليسوسوم. وإذا كانت الحموضة في تلك البيئة غير صحيحة، فإن الإنزيمات داخل الليسوسومات تتوقف عن العمل بشكل فعال، ولا تستطيع العضيات أداء أدوارها بشكل صحيح.
( المقالة )
في حوالي خُمس حالات مرض باركنسون، انظر إلى بروتين صغير معطل في الليسوسوم (1) كعامل خطر، كما يقول باحثون من جامعة ميشيغان.
والليسوسومات هي جامعة القمامة للخلايا. وهذه العضيات مسؤولة عن تحطيم “القمامة” في الخلية – البروتينات المشوهة، والعضيات المهترئة – التي تجمعها الخلايا في عملية تسمى الالتهام الذاتي. ويعتمد الالتهام الذاتي بشكل وثيق على وظيفة الليسوسوم، وعندما تتعطل الليسوسومات وتتعطل هذه العملية، متسببة في تراكم الحطام الخلوي، يمكن أن تحدث اضطرابات مختلفة. والعديد من هذه الاضطرابات هي اضطرابات تنكسية مثل مرض الزهايمر وضمور دوشين العضلي(2) ومرض تاي ساكس(3).
والآن، اكتشف باحثو جامعة ميشيغان كيف يعمل بروتين متحور يسمى بروتين عبر الغشاء 175 (TMEM175)(4) كعامل خطر في حوالي 20٪ من حالات مرض باركنسون، وفيه تبدأ الخلايا العصبية في منطقة الدماغ التي تتحكم في الحركة بالفشل والموت. ووفقًا للمعهد الوطني للشيخوخة، يعتقد الباحثون أن مرض باركنسون ناتج عن مجموعة من العوامل الوراثية والبيئية.
وقد وجد باحثو جامعة ميشيغان أنه إذا تم التحور، فإن بروتين عبر الغشاء 175 لا ينظم بشكل صحيح حموضة البيئة داخل الليسوسوم. وإذا كانت الحموضة في تلك البيئة غير صحيحة، فإن الإنزيمات داخل الليسوسومات تتوقف عن العمل بشكل فعال، ولا تستطيع العضيات أداء أدوارها بشكل صحيح. وقد تم نشر نتائج دراستهم في مجلة “خلية”.
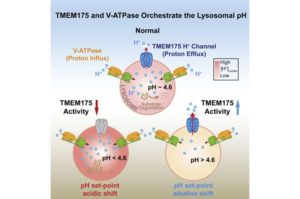
وقال المؤلف الرئيسي للورقة البحثية البروفيسور “هاوكسينغ اكسو” (Haoxing Xu)، أستاذ علم الأحياء الجزيئي والخلوي والتطوري: “في الحقيقة، يحتاج الليسوسوم درجة حموضة مثالية. تبلغ 4.6 تقريبًا. هنا تشبيه: درجة حرارة الجسم يجب أن تكون 37 درجة مئوية. ثمانية وثلاثون مرتفع جدًا و 36 منخفض جدًا”. وتابع: “تتطلب الإنزيمات الموجودة في الليسوسومات درجة حموضة تبلغ 4.6 تقريبًا. قد يتسبب أي شيء خارج درجة الحموضة 4.6 في حدوث خلل في التمثيل الغذائي، وبالتالي تراكم القمامة الخلوية، مما يؤدي في النهاية إلى حدوث تنكس عصبي وأمراض استقلابية (أيضية)”.
وللحفاظ على الليسوسوم في حالة توازن حمضي، عرف البروفيسور اكسو أنه لا بد من وجود قناة أيونية تنظم حموضة تلك البيئة من خلال تنظيم تركيز أيونات الهيدروجين (تسمى البروتونات في هذا السياق – نواة ذرة الهيدروجين مع تجريد الذرة من إلكترونها) داخل الليسوسوم.
وقام البروفيسور اكسو، بمساعدة المؤلفين المشاركين ومنهم البروفيسور ريتشارد هيوم، أستاذ علم الأحياء الجزيئي والخلوي والنمائي بجامعة جامعة ميشيغان، بتحديد الحموضة الدقيقة لتجويف الليسوسوم. وبعد ذلك، قام الباحثون بتمشيط قائمة البروتينات المرتبطة بالليسوسوم ولكن لم يتم وصفها بشكل جيد بعد.
وما تم فهمه جيدًا هو كيفية دخول البروتونات إلى الليسوسومات: هناك ناقل غشاء محدد يسمى انزيم “في-ايه تي بيس” (V-ATPase) (5) يقوم بتحميل البروتونات، ولكن ما لم يكن واضحًا هو كيفية الوصول إلى التوازن، أو كيفية وصول درجة الحموضة إلى 4.6 وعدم السماح لها بالاستمرار. وأكثر حمضية، حسب البروفيسور هيوم. وتشير بعض الأدلة غير المباشرة إلى وجود قناة نفاذة للبروتون في الليسوسومات التي كان أساسها الجزيئي غير معروف والتي كانت مرتبطة بطريقة ما باستتباب درجة الحموضة.
وقال البروفيسور اكسو: “كنا مهتمين أنه إذا كان هناك انزيم “في-ايه تي بيس” لضخ البروتون فيه، فيجب أن يكون لليسوسومات بروتين قناة أيونية لإطلاق البروتون عندما يكون مستوى البروتون مرتفعًا جدًا داخل الليسوسوم”.
ولدراسة القنوات الأيونية في الليسوسوم ، طور مختبر البروفيسور اكسو سابقًا تقنية متخصصة تسمى مشبك تصحيح الليسوسوم. ويسمح مشبك التصحيح للباحثين “بتشغيل” قنوات أيونية معينة بشكل انتقائي في الليسوسوم من أجل فهم وظيفتها بشكل أفضل. واستخدم الباحثون هذه التقنية لإيجاد قنوات للأيونات الأخرى: الكالسيوم، والصوديوم، والبوتاسيوم، والكلوريد، والحديد، والآن البروتونات.
وقام باحثو ما بعد الدكتوراه والمؤلفون المشاركون في جامعة ميشيغان ميكين هو وبنغ لي بعمل قائمة بجميع الجينات التي تشفر بروتينات الغشاء المعروف أنها موجودة في الليسوسومات، ثم قاموا بما يسمى اختبار فحص الإفراط في التعبير. وهذا يعني أن الباحثين اختبروا عشرات البروتينات الغشائية واحدًا تلو الآخر لمعرفة ما إذا كان غشاء الليسوسوم أصبح أكثر نفاذية للبروتونات. وقد يشير هذا إلى أن أحد المرشحين الذين قاموا بفحصهم كان مسؤولاً عن تدفق البروتون في الليسوسوم.
ركز الباحثون على الغشاء “عبر الغشاء 175” ، والذي أعطى نفاذية البروتون المحسنة بشكل كبير في اختبار الفحص، كما ذكر البروفيسور هيوم.
وقال البروفيسور هيوم: “لقد جعل هذا ميكين وهاكسينغ وبقية العاملين في المختبر متحمسين حقًا، لأن هذا البروتين لم يكن معروفًا تمامًا”. وتابع: “الأهم من ذلك، أنه أحد الجينات الأكثر عرضة للطفرات التي تسبب مرض باركنسون”.
وتركزت التخمينات السابقة حول كيف كان البروتين عامل خطر للإصابة بمرض باركنسون حول فحص وظيفته كقناة للبوتاسيوم.
وقال البروفيسور هيوم: “بصراحة تامة، لم تكن هذه التفسيرات منطقية لأنه من الصعب تبرير آلية مثل تغيير تدفق البوتاسيوم عبر الليسوسوم كان يجب أن يؤدي إلى عجز شبيه بمرض باركنسون”. وأضاف: “ولكن بمجرد أن أدرك المرء أن بروتين عبر الغشاء 175 ربما كان قناة بروتونية، فإن الأساس المنطقي لكيفية حدوث طفرة في هذا البروتين في التسبب في مرض باركنسون بدا واضحًا للغاية”.
وقام الباحثون بمراجعة عملهم بطريقتين. فأولا، استخدم طالبا الدكتوراه “هو” و “سي وانغ” التصوير بالبروتون، باستخدام مؤشرات الفلورسنت البروتينية، لقياس حموضة الليسوسومات عندما تخلصوا من بروتين عبر الغشاء 175. وثانيًا، استخدموا الفئران التي تراجعت قدرتها على إنتاج بروتين عبر الغشاء 175. وهذا يعني أنهم لم يصنعوا قناة البروتين الناقلة هذه في الليسوسومات الخاصة بهم. وأظهر الفريق تراكم “ألفا سينوكلين” (alpha-synuclein) في خلايا الفئران المنكوبة. ومن المعروف أن تراكم ألفا سينوكلين سام في مرضى باركنسون.
وفي كلتا الحالتين، أظهرت الخلايا انخفاضًا في النشاط الإنزيمي الذي يكسر النفايات الخلوية، بما في ذلك تكتلات ألفا سينوكلين، مما يشير إلى أن بروتين عبر الغشاء 175 كان مسؤولاً عن تنظيم الحموضة الخلوية وتدهورها.
وقال البروفيسور اكسو: “في النهاية، نحن واثقون جدًا من أن هذا هو البروتين الذي يتحكم في تسرب البروتون في الليسوسوم”. وأضاف: “هذه الورقة البحثية مثيرة لأن الطفرات في هذا البروتين تصادف أنها عالية الخطورة للإصابة بمرض باركنسون”.
*تمت الترجمة بتصرف
المصدر:
https://phys.org/news/2022-06-reveal-molecular-mechanism-parkinson-disease.html
لمزيد من المعلومات: ميكين هو وآخرون، Parkinson’s disease-risk protein TMEM175 is a proton-activated proton channel in lysosomes, Cell (2022). DOI: 10.1016/j.cell.2022.05.021
الهوامش:
- الايسوسوم: عضية في السيتوبلازم للخلايا حقيقية النواة تحتوي على إنزيمات متحللة محاطة بغشاء.
- الحثل العضلي الدوشيني (DMD) هو نوع حاد من الحثل العضلي الذي يصيب الأولاد بشكل أساسي. يبدأ ضعف العضلات عادة في سن الرابعة تقريبًا ، ويزداد سوءًا بسرعة. عادةً ما يحدث فقدان العضلات أولاً في الفخذين والحوض يليهما الذراعين. هذا يمكن أن يؤدي إلى مشكلة في الوقوف. معظمهم غير قادرين على المشي في سن 12 عامًا. قد تبدو العضلات المصابة أكبر بسبب زيادة محتوى الدهون. الجنف شائع أيضًا. قد يعاني البعض من إعاقة ذهنية. قد تظهر أعراض خفيفة على الإناث المصابات بنسخة واحدة من الجين المعيب. ويكيبيديا
- مرض تاي ساكس (Tay-Sachs) هو اضطراب وراثي نادر ينتقل من الآباء إلى الأطفال. إنه ناتج عن عدم وجود إنزيم يساعد في تكسير المواد الدهنية. تتراكم هذه المواد الدهنية، المسماة غانغليوسايدرس (Gangliosides)، إلى مستويات سامة في الدماغ والحبل الشوكي وتؤثر على وظيفة الخلايا العصبية. في الشكل الأكثر شيوعًا وشدة لمرض تاي ساكس، تبدأ العلامات والأعراض في الظهور في عمر 3 إلى 6 أشهر تقريبًا. مع تقدم المرض، يتباطأ النمو وتبدأ العضلات في الضعف. بمرور الوقت، يؤدي هذا إلى حدوث نوبات وفقدان البصر والسمع والشلل وغيرها من المشكلات الرئيسية. عادةً ما يعيش الأطفال المصابون بهذا النوع من مرض تاي ساكس بضع سنوات فقط. المصدر: موقع مايو كلينيك.
- بروتين عبر الغشاء 175 (TMEM175)، هو بروتين عبر الغشاء يُعتقد أنه قناة بوتاسيوم داخل ليسوسوم داخلي. من المتوقع أن يكون لديها العديد من تقويمات العظام عبر حقيقيات النوى. ويكيبيديا.
- إنزيم “ايه تي بيس” من النوع الفراغي (V-ATPase) هو إنزيم قديم تطوريًا محفوظًا للغاية وله وظائف متنوعة بشكل ملحوظ في الكائنات حقيقية النواة. يعمل الانزيم على تحميض مجموعة واسعة من العضيات داخل الخلايا وتضخ البروتونات عبر أغشية البلازما لأنواع عديدة من الخلايا. ويكيبيديا.

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية