The human body has 37 trillion cells. If we can work out what they all do, the results could revolutionise healthcare
(بقلم: دانيال إم ديفيس، برفسور المناعة بجامعة مانشستر – Daniel M. Davis)
جسم الانسان العادي يحتوي على نحو 37 تريليون خلية (الترليون الواحد = مليون مليون) – نحن في خضم مشروع ثوري لفهم ما تفعله كل خلية من هذه الخلايا. يتطلب كشف هذا الأمر خبرة متخصصين بخلفيات علمية مختلفة – متخصصو حوسبة وعلم أحياء وأطباء ورياضيات – بالإضافة إلى تكنولوجيا جديدة [ومنها الذكاء الاصطناعي وتعلم الآلة] وبعض الخوارزميات المعقدة جدًا.
في وقت كان من شأن المجهر البدائي، وهو في الأساس أكبر بقليل من عدسة مكبرة، أن يكشف عن خلية جديدة بشكل مباشر وعميق – بنفس الطريقة التي اكتشف بها أنطوني ڤان ليوينهوك (Antonie van Leeuwenhoek) الحويمنات في عام 1677م(1) – أما اليوم فالتحليل من على شاشة كمبيوتر ويوافينا بمثل هذه الاكتشافات. لكنها رائعة بنفس القدر.
هذا النوع من الدراسات صعب من جميع النواحي – من العلم نفسه إلى علم الاجتماع (ساسيولوحيا) الفرق البحثية الكبيرة التي تعمل عليه – لكن المردود قد يكون وافرًا. من المؤكد أنه كان بفضل الكونسورتيوم الذي يضم 29 باحثًا شرعوا في التعرف على أنواع الخلايا التي تبطٍّن القصبة الهوائية – واكتشفوا نوعًا جديدًا من الخلايا يمكن أن يغير فهمنا لـ التليف الكيسي(2) وعلاجه.
في المرة الأولى التي صادف فيها الفريق – بقيادة أڤيڤ ريجيف (Aviv Regev) من معهد برود (Broad Institute) في معهد ماساتشوستس للتكنولوجيا وجامعة هارفارد – هذه الخلايا، حيث كانوا يدرسون حينها نتائج تحليل 300 خلية في القصبة الهوائية لفئران. يبدو أن ثلاث خلايا لا تتشابه مع أي من الخلايا التي شوهدت في السابق. لو كانت خليتين فقط ، لربما صرفوا النظر عنها واعتبروها نتيجة ضوضاء في البيانات – لكن ثلاث خلايا غريبة تستدعي إلقاء نظرة فاحصة عليها.
كدعابة مختبر، هذه الخلايا أصبحت تعرف لاحقًا باسم “الخلايا الساخنة”. كرر الباحثون التجربة عدة مرات، وسرعان ما أصبح واضحًا أنهم عثروا بالفعل على نوع جديد من الخلايا في القصبة الهوائية.
كما اتضح، وجد فريق آخر من الولايات المتحدة وسويسرا بشكل مستقل نوع الخلايا نفسه. علم الفريقان عن عمل كل منهما عن طريق الصدفة أثناء ندوة عُقدت في عام 2017. يتذكر موشيه بيتون (Moshe Biton) من فريق معهد برود قائلاً: “كانت واحدة من تلك اللحظات الجميلة للعلم، عندما توصلت المجموعتان إلى نفس النتائج بشكل مستقل”.
أكدت كلتا المجموعتين البحثيتين أن هذه الخلايا الجديدة موجودة في القصبة الهوائية البشرية وكذلك في الفئران، وبعد اجتماع حصل بين الفريقين البحثيين، اتفقا على نشر ورقتيهما بجنب بعضهما(3). لم تُلاحظ هذه الخلايا الجديدة في السابق، وذلك ببساطة لأنها نادرة جدًا – فهي تشكل حوالي 1٪ من الخلايا في القصبة الهوائية. لكن هذا لا يعني أنها ليست خلايا مهمة. عندما نظر فريقا البحث بالتفصيل في ما ميز هذه الخلايا، صادفوا شيئًا مذهلاً. تبين أن أحد الجينات النشطة في خلايا القصبة الهوائية المكتشفة حديثًا هو جين (CFTR) – جين “منظم التوصيل عبر الغشاء في التليف الكيسي”. مما أعطى نتائج بحثيهما مستوى آخر تمامًا من المعنى لأن الطفرات (التحورات) في هذا الجين تسبب التليف الكيسي(4).
بالضبط كيف يمكن أن يكون سبب هذا المرض وراثة نسخة مختلة وظيفيًا من جين (CFTR) أحجية منذ اكتشاف العلاقة بين مرض التليف الكيسي وهذا الجين عام 1989م(4). التليف الكيسي مرض معقد / مركب، يبدأ عادةً في مرحلة الطفولة، وغالبًا ما تشمل الأعراض التهابات رئوية وصعوبة في عمليه التنفس. هناك علاجات (أدوية تخفف من المرض) ولكن ليس هناك علاج له (شفاء منه).
الآن يبدو من الممكن أن المفتاح لفهم السبب قد يكمن في معرفة ما تفعله هذه الخلايا المكتشفة حديثًا، وماذا يحدث لهذه الخلايا إذا كان جين (CFTR) مختلًا وظيفيًا.
ولكن ما وُجد بالفعل من هذا الاكتشاف وغيره من الأبحاث التي تستخدم طرقًا مماثلة، هناك إحساس بأن فهمنا لخلايا الجسم قد تحول من خلال توظيف علم الأحياء مع علم الحوسبة. ومن هنا الاكتشافات التي ستغير قواعد اللعبة على وشك الظهور.
تنوع الخلايا البشرية
كل خلية من الخلايا ال 37 تريليون في جسم الانسان فريدة من نوعها إلى حد ما. بروتينات الخلية هي التي تحدد نوعها – وعليه خلية الدم الحمراء تحتوي فقط على هيموغلوبين، على سبيل المثال، والخلايا العصبية(5) تحتوي على بروتينات مختلفة عن الخلايا المناعية(6). لا توجد خليتان في الجسم تحتويان بالضبط على نفس الكمية من كل بروتين.
جهاز المناعة معقد بشكل خاص(7). ويتكون من العديد من أنواع الخلايا المصنفة حسب وظيفتها الأساسية – الخلايا التائية والخلايا البائية وما إلى ذلك. ولكن هناك أيضًا عدد لا يحصى من التباينات التفصيلية الدقيقة لهذه الخلايا التائية والخلايا البائية. ولا نعرف بالفعل عدد المتحورات الموجودة – ولكن لو تمكنا من فهم ما تقوم به كل خلية منها، فسنفهم جهاز المناعة بشكل أفضل. وهذا بدوره سيمكننا من تصميم أدوية جديدة لمساعدة الجهاز المناعي، على سبيل المثال، على محاربة السرطان بشكل أفضل.
يُطلق على أحد أنواع الخلايا المناعية التي يدرسها فريقي البحثي بجامعة مانشستر [الكلام للمؤلف دانيال ديڤيس] اسم الخلية القاتلة الطبيعية(8). يوجد حوالي ألف من هذه الخلايا المناعية في كل قطرة دم، وهي جيدة بشكل خاص في اكتشاف وقتل الخلايا الأخرى التي تتحول الى خلايا سرطانية أو أصيبت بفيروس. مرة أخرى، ليست كل الخلايا القاتلة الطبيعية متشابهة. قدر أحد التحليلات(9) أن هناك عدة آلاف من المتحورات لهذه الخلية المناعية في أي واحد من الناس.
في عام 2020، أجرى مختبري البحثي [الكلام للمؤلف دانيال ديڤيس] تحليلاً(10) والذي اقترح أنه يمكن تتظيم أنواع مختلفة من متحورات الخلايا القاتلة الطبيعية في الدم في ثماني فئات. على الرغم من أن أدوارها المختلفة في الجسم لم تُعرف بالكامل بعد، فمن المحتمل أن يكون البعض منها بارعة بشكل خاص في مهاجمة أنواع معينة من الفيروسات، والبعض الآخر أفضل في اكتشاف الخلايا السرطانية، وما إلى ذلك.
أنواع أخرى من الخلايا المناعية يمكن أن تكون أكثر تنوعًا. من الواضح أن خلايانا متنوعة كتنوع البشر المكوَّنينَ من هذه الخلايا، ومعرفة كيف تعمل مثل هذه المجموعات المعقدة من الخلايا معًا (في هذه الحالة، للدفاع ضد المرض) يُعتبر أفقًا حيويًا.
توظيف لغة الخوارزميات
لاختراق هذا التعقيد، يجب ترجمة تنوع الخلايا البشرية إلى لغة الخوارزميات.
تخيل أن الخلية تحتوي على نوعين فقط من البروتينات، X و Y. كل خلية من الخلايا سيكون لها كمية معينة من كل من هذين البروتينين. يمكن تمثيل ذلك بنقطة على رسم بياني حيث تصبح كمية البروتين X نقطة على المحور السيني، وكمية البروتين Y نقطة على المحور الصادي.
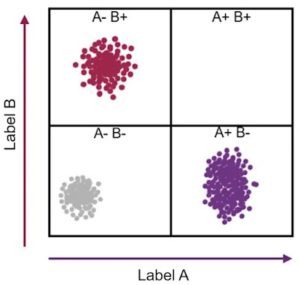
قد تحتوي إحدى الخلايا على كمية عالية من بروتين X وقليل من بروتين Y (والذي يمكن الكشف عنه بواسطة مقياس التدفق الخلوي(11) الذي يوضح أن الخلية تلطخ بكمية عالية من أحد الأجسام المضادة وكمية منخفضة من جسم مضاد آخر). يمكن بعد ذلك تمثيل هذه الخلية كنقطة بعيدة على طول المحور السيني وأعلى قليلاً على المحور الصادي.
حين تشغل كل خلية مكانًا على الرسم البياني، فإن تلك التي تحتوي على كميات مماثلة من بروتين X وكذلك بروتين Y – من المحتمل أن تكون من نفس النوع من الخلايا – تظهر كتجمع (تكتل) من نقاط على بعضها. لو رسمنا آلاف أو ملايين الخلايا بهذه الطريقة على المحورين السيني والصادي، فإن عدد تجمعات (تكتلات) النقاط المنفصلة التي تنبثق من هذه العملية يخبرنا عن عدد أنواع الخلايا الموجودة. أيضًا، عدد النقاط داخل الكتلة تخبرنا عن عدد الخلايا الموجودة من هذا النوع.
الشيء الرائع هو أن هذا النوع من التحليل يمكن أن يكشف عن عدد أنواع الخلايا الموجودة، على سبيل المثال، في عينة من الدم أو خزعة من الورم، دون أن نُرشد بأي طريقة من الطرق إلى أي الخلايا نتوقع أن نجدها. هذا يعني أنه يمكن أن تظهر نتائج غير متوقعة من هذه الطريقة. قد يظهر تكتل من نقاط بيانات بخصائص غير متوقعة – مما يدل على اكتشاف نوع جديد من الخلايا.
بالطبع، تحتاج الخلايا إلى أكثر من إحداثيين [س و ص] لكي توصف. في الواقع ، على مدى العقد الماضي، طُور نوع من التحليل – يُعرف باسم تسلسل الحمض الريبوزي أحادي الخلية [عمل التسلسل باستخدام خلية واحدة(12)] – لقياس مدى استخدام كل خلية لكل من الجينات البشرية البالغ عددها 20 ألف جين في كل خلية.
يمكن بعد ذلك تحليل أي من الجينات البشرية التي تستخدمها خلية معينة من بين جميع الجينات البشرية البالغ عددها 20 ألف جين – والتي تسمى ترنسكريبتوم [transcriptome(13، 14)] – لوضع “خريطة” لخلايا مختلفة. لا يمكننا تخيل خلايا ممثلة على رسم بياني يحتوي على 20 ألف محور، ولكن يمكن لخوارزمية كمبيوتر التعامل مع هذا التحليل بنفس الطريقة التي تتعامل بها مع متغيرين فقط. تُوضع الخلايا المتشابهة بالقرب من بعضها على المحور، بينما توضع الخلايا التي تستخدم مجموعات مختلفة جدًا من الجينات متباعدة عن بعضها.
الخوارزميات(15) المطلوبة لعمل هذه الحوسبة مستعارة من علوم أخرى، مثل تلك المستخدمة في تحليل الشبكات الاجتماعية. ولهذا لا نحتاج سوى عدة أيام، اذا لم تحتج الى سنوات للتنقيب عن معلومات ناتجة وفك رموز ما تعنيه الخريطة: أي عدد أنواع الخلايا، والعوامل التي تحدد اختلافاتها، وماهي مفاعيلها في الجسم؟
في الوقت الحالي، يُعمل على هذا المشروع على نطاق غير مسبوق بفضل كونسرتيوم أطلس الخلايا البشرية(16) – مما أدى إلى جميع أنواع الاكتشافات عن جسم الإنسان.
أطلس الخلايا البشرية
في أكتوبر 2016، نظم ريجڤ (Regev) و سارة تايكمان (Sarah Teichmann) من معهد ويلكوم سانغر (Wellcome Sanger) اجتماعًا في لندن لحوالي 100 باحث رائد لمناقشة كيف يمكن أن تمثل كل خلية في جسم الإنسان على الرسم البياني(17). كان حديث المصاعد(18) هو تجميع شيء ما يُشبه خرائط قوقل (Google) للجسم: “نحن نعرف الدول والمدن الرئيسة، والآن نحتاج إلى رسم خريطة للشوارع والمباني” [ المترجم: استعارة تعني ما يقابلها في الجسم البشري].
بعد عام، قاموا بصياغة خطة معينة – لمحاولة تصنيف أنواع 100 مليون خلية من اجهزة وأعضاء مختلفة في الجسم، مستخدمين أشخاص مختلفين من حول العالم. انضم آلاف الباحثين في أكثر من 70 دولة من كل قارة مأهولة إلى الكونسرتيوم منذ ذلك الحين – هذا التجمع يعتبر تجمعًا متنوعًا بشكل خاص ، بالضبط كما ينبغي أن يكون لمثل هذا المشروع العلمي العالمي الضخم.
من نواح كثيرة، هذا الطموح الجديد الجريء هو نتاج مباشر لمشروع الجينوم البشري (19). من خلال عمل تسلسل لجميع الجينات البشرية الموجودة في كل خلية بشرية، والتي اكتملت رسميًا في أبريل 2003 ، تم ربط جميع أنواع التباينات الجينية بالقابلية المرتفعة للإصابة بمرض معين.
ومع ذلك، تظهر الأمراض الوراثية في خلايا معينة حيث يستخدم هذا الجين بشكل طبيعي. لذلك، وبشكل حاسم، لا يكفي تحليل الجينات وحده – نحتاج أيضًا إلى معرفة أين تُفعَّل هذه الجينات المسببة للأمراض في جسم الإنسان.
يعمل أطلس الخلايا البشرية على سد هذه الفجوة بين الشفرات الوراثية المجردة ومادية جسم الإنسان. لقد رأينا بالفعل مثالًا واحدًا على مدى أهمية ذلك – اكتشاف جين التليف الكيسي الذي تستخدمه خلايا جديدة نادرة. مثال آخر عما يحدث أثناء الحمل يتبع.
كشف أسرار الحمل
لسنوات عديدة، عرفنا أن الجهاز المناعي مرتبط ارتباطًا وثيقًا بالحمل. على سبيل المثال، بعض توليفات جينات الجهاز المناعي موجودة بشكل أكثر تواترًا قليلًا مما هو متوقع بالصدفة لدى الأزواج الذين تعرضوا لثلاث حالات إجهاض أو أكثر. على الرغم من أننا لا نعرف سبب ذلك حتى الآن، إلا أن البحث فيها قد يكون مهمًا من الناحية الطبية في حل المشكلات أثناء الحمل.
لمعالجة هذه المشكلة، قام كونسورتيوم من الباحثين (بقيادة تيكمان “Teichmann” كجزء من مشروع أطلس الخلايا البشرية) بتحليل حوالي 70 ألف خلية من المشيمة وبطانة الرحم من النساء اللائي أنهين حملهن بالاجهاض بين ستة و 14 أسبوعًا.
المشيمة هي العضو الذي تنتقل اليه ومنه المغذيات والغازات بين الأم والجنين النامي. كان يعتقد سابقًا أن على الجهاز المناعي للأم أن يتوقف عن العمل في بطانة الرحم حيث تنغرس المشيمة، بحيث لا تُهاجم المشيمة ولا الجنين لكونهما “جسمين غريبين” (كما يحدث بعد عملية زرع عضو غير متوافق) لأن نصف جينات الجنين قادمة من الأب. لكن تبين أن وجهة النظر هذه خاطئة – أو بسيطة بشكل مفرط على أقل تقدير.
نحن نعلم في الوقت الحالي، وذلك من اجراء مجموعة متنوعة من التجارب بما في ذلك هذا التحليل، أنه في الرحم، يضعف نشاط الخلايا المناعية للأم إلى حد ما، ويفترض أنه لمنع حدوث رد فعل عكسي ضد خلايا الجنين، ولكن الجهاز المناعي لا يتوقف. ولكن، الخلايا المناعية التي ذكرناها سابقًا، وهي الخلايا القاتلة الطبيعية، والمعروفة جيدًا بقتل الخلايا المصابة أو الخلايا السرطانية، تقوم بوظيفة مختلفة تمامًا وبناءة بشكل أكثر في الرحم. وهي المساعدة في تشييد المشيمة.
تحليل الباحثين لـ 70 ألف خلية أبرز أيضًا أن جميع أنواع الخلايا المناعية الأخرى مهمة في تشييد المشيمة. ما تفعله كل خلية منها لم يتضح بعد – هذا على حد معرفتنا.

موزلفة “موز” حنيفة هي واحدة من ثلاث نساء قادت هذا التحليل. كطبيبة وباحثة، تنظر يوميًا إلى الجسم بمنظورين تقريبًا: كتحليل حوسبي للخلايا على الشاشة وكأشخاص مرضى.
في الوقت الحالي، هذان المنظوران لا يتداخلان بسهولة. لكن في الوقت المناسب، سيكون هناك تداخل. في المستقبل، تعتقد الدكتورة حنيفة أن الأدوات التي يستخدمها الأطباء بشكل يومي – كسماعة الطبيب للاستماع إلى رئتي الشخص، أو تعداد الدم البسيط (20) – ستستبدل بأدوات تحدد بروفايل خلايا الجسم. ستقوم الخوارزميات بتحليل النتائج وتوضيح المشكلة التي وراء المرض والتنبؤ بأفضل علاج لها. العديد من الأطباء الآخرين يتفقون مع الدكتورة حنيفة – هذا هو المستقبل القادم للرعاية الصحية.
ماذا يمكن أن يعني هذا بالنسبة لك
الأطفال يولدون في الوقت الحالي بشكل روتيني عن طريق التلقيح الاصطناعي ، وأصبحت عمليات زرع الأعضاء شائعة، وتضاعفت معدلات الشفاء من السرطان في المملكة المتحدة تقريبًا في السنوات الأخيرة – ولكن كل هذه الإنجازات لا تعتبز شيئًا بالمقارنة بالانجازات المتوقعة في المستقبل.

كما ذكرت عن ذلك في كتابي: الجسم الغامض (The Secret Body(21)) ، التقدم في البيولوجيا البشرية يتسارع بمعدل غير مسبوق – ليس فقط من خلال أطلس الخلايا البشرية ولكن في العديد من المجالات الأخرى أيضًا. تحليل جيناتنا يقدم فهماً جديداً لمدى اختلافنا(22)؛ ما تقوم به خلايا الدماغ تزودنا بقرائن على كيف تعمل عقولنا؛ البنيويات الجديدة التي وُجدت داخل خلايانا تساهم بأفكار جديدة للطب؛ البروتينات والجزيئات الأخرى الموجودة في دمائنا تغير نظرتنا للصحة النفسية.
بالطبع، كل مجالات العلوم لها تأثير متزايد في حياتنا، لكن لا شيء يؤثر فينا بشكل عميق أو مباشر كما تؤثر الاكتشافات الجديدة عن جسم الإنسان. يبدو في الأفق الآن، من كل هذا الأبحاث، أن هناك طرقًا جديدة تمامًا للفحص وتشخيص الأمراض و علاجها.
لقد اعتدنا بالفعل على فكرة أنه يمكن استخدام معلوماتنا الجينية الشخصية لتشخيص أمراضنا. لكن هناك ثورة أكثر هدوءًا – سرية تقريبًا – جارية أيضًا وقد يكون لها تأثير أكبر في مستقبل الرعاية الصحية: تحليلات عميقة لخلايا جسم الإنسان.

في يوم من الأيام، سيُنظر إلى ساعة يد تستطيع فحص بعض الأشياء البسيطة في الجسم على أنها أداة بدائية مثيرة للضحك. في المستقبل، ربما في غضون عشر سنوات أو نحو ذلك، ستتوفر سحابة كاملة من المعلومات – بما في ذلك تحليل جميع خلايا الجسم – وسيتعين علينا تحديد مقدار ما نريد الخوض في تفاصيله. هذه الثورة في علم الأحياء البشري ستزود كل فرد منا بقدرات جديدة – وسيحتاج كل منا أن يقرر بنفسه ما إذا يريد أن يوظفها ومتى.
على سبيل المثال، قد تقوم بزيارة عيادة طبيبك يومًا ما لفحص شيء غير طبيعي ظهر على جلدك – طفح جلدي أو حكة أو أي شيء آخر. قد يأخذ الطبيب حينها عينة صغيرة من جلدك، أو ربما عينة دم، ومن تحليل كامل لكل خلية من الخلايا الموجودة في العينة، ليتمكن من تشخيص المشكلة بدقة ومعرفة أفضل علاج لها. في الواقع، قد يكون بعض من هذا الفحص آليًا. في المستقبل، إذا أصبحت المعدات اللازمة للقيام بذلك صغيرة ورخيصة بما يكفي ، فربما تتمكن من إجراء التحليل بنفسك في منزلك.
غالبًا ما سيُتنبأ أيضًا بالأمراض قبل ظهور أي من أعراضها على الإطلاق. بالطبع، هذه واحدة من أهم مهام العلم: وهي منع المرض الذي يصيب الإنسان من الظهور قبل أن يبدأ. بالنسبة لبعض الأمراض، تم تحقيق ذلك بالفعل – وذلك من خلال اللقاحات وشرب المياه النظيفة والصرف الصحي المحسن. الآن، مع انكشاف جسم الإنسان لنا من خلال التحليل الحوسبي للخلايا والجينات وغيرها، تظهر طرق جديدة لاستباق المرض. نحن مضطرون لاغتنام هذه الفرصة الجديدة – ولكن بالممارسة العملية ، هناك تحديات وتبعات غير مقصودة علينا التصدي لها.
خذ مثالاً معروفًا: فكرة مؤشر كتلة الجسم، وهي قيمة تحسب من وزن الشخص وطوله. يستخدم هذا المؤشر لتصنيفنا على أننا إما دون الوزن الطبيعي أو ضمن الوزن الطبيعي أو فوق الوزن الطبيعي أو نعاني من السمنة. هذا المؤشر يعتبر مفيدًا لأنه يشير إلى زيادة احتمال ظهور مشكلات صحية، كداء السكري من النوع 2، وبهذا يمكن اتخاذ خطوات لتقليل احتمالية الاصابة به. لكن الوصم بالسمنة نفسها يمكن أن تثير أيضًا أنواعًا أخرى من المشكلات المتعلقة بقيمة الفرد الذاتية، وكيف ينظر المجتمع إلى السمنة والتنوع البشري [كالعرق والاثنية، والجنس وما الى ذلك].
قرارات صعبة بشأن كيف تعيش
كل واحد منا عرضة لبعض الأمراض أو غيرها، إلى حد ما. لذلك مع تقدم العلم ومعرفتنا بالمزيد والمزيد عن أنفسنا، سنجد أنفسنا بالتأكيد غارقين في كمية من البيانات الهائلة عن أنفسنا، وغارقين في التقديرات والاحتمالات التي تلعب بعقولنا وهوياتنا، وتتطلب منا اتخاذ قرارات صعبة بشأن صحتنا وكيف نعيش.
يبدو أنه من الممكن، على سبيل المثال، أن يساعد التحليل الدقيق لحالة الجهاز المناعي للشخص في التنبؤ بالأعراض التي من المحتمل أن يعاني منها لو أصيب بفيروس سارس-كوف-2 ، على سبيل المثال. علامات النشاط المناعي قد تتلازم طرديًا مع صحة الشخص العقلية. خلص أحد التحليلات إلى أن إفرازات معينة محرضة على الالتهابات من الخلايا المناعية (تسمى السيتوكينات) توجد بمستويات عليا لدى الأشخاص المصابين بالاكتئاب(23).
عندما نعرف مكونات جسم الإنسان وحالته، فإن هذا سيؤسس حتماً طرقًا جديدة لتقييم صحته. وقد يساعد في حل مشكلات الحمل أيضًا، كما رأينا. ولكن توجد مشكلات هنا أيضًا – إذا كان التحليل يفيد باحتمال حدوث مشكلة، لنقل أن مقدار الاحتمال هو 50٪ ، فكيف ستتصرف بناءً على هذه المعلومات إذا كان التدخل الطبي الذي قد يكون مفيدًا له مخاطره الخاصة به أيضًا؟
يبدو أنه لا يوجد حد لكيف سيؤدي التحليل الكمي لجسم الإنسان إلى قرارات صحية جديدة مهمة ولكنها معقدة. اشتهرت أنجلينا جولي (Angelina Jolie) بالتصرف بناءً على المعلومات الجينية عندما أزيل ثدياها جراحياً في عام 2013، ثم بعد ذلك مبيضها وقناتا فالوب منها ، بعد أن عمل لها فحص جيني أثبت أنها ورثت طفرة معينة في جين يعرف باسم (BRCA1). بشكل حاسم، أخبرت بأن لديها فرصة عالية جدًا – 87 ٪ – للإصابة بسرطان الثدي. بشكل عام المخاطر والاحتمالات المتعلقة بصحتنا أقل وضوحًا من ذلك.
لذا فإن السؤال الذي يطرح نفسه، كيف لنا أن نتصرف في وجود كل هذه المعلومات الجديدة؟ ماذا لو شُخص شيء ما والذي يعني أن احتمال الإصابة بأحد أمراض المناعة الذاتية أو السرطان هو واحد من ستة في السنوات العشر القادمة؟ هل سيكون الأمر مختلفًا لو كان الاحتمال واحدًا من أربعة؟ في أي مرحلة ستقرر البدء في تناول الدواء كإجراء احترازي، أو اجراء عملية جراحية، مع علمك أن هذه العملية تنطوي أيضًا على مخاطر؟ وهل هذه المعرفة في حد ذاتها تجعلك تشعر بالمرض؟ هل ستتأثر؟
ليس لدي الإجابات – ولكن هذا هو بيت القصيد. مع تقدم هذا العلم الجديد، سيتعين على كل واحد منا أن يقرر إلى أي مدى يريد بالفعل أن يعرف عن نفسه.
مصادر من داخل وخارج النص:
1- https://377.medium.com/first-person-in-the-world-who-discovered-the-sperm-cells-6c91b17a8df5#:%7E:text=Sperm%20were%20unknown%20to%20science,filled%20with%20tiny%2C%20wiggling%20cells.
2- “التليف الكيسي هو مرض وراثي صبغي جسمي متنحّ يحدث بسببه عجز مترقٍّ في عمل الغدد خارجية الإفراز، مما يُؤثر في وظائف متعددة في الجسم. فهو يُؤثر بصورة كبيرة في الرئتين، وبنسبة أقل في البنكرياس والكبد والأمعاء، حيث يُؤدي إلى تراكم طبقة سميكة ولزجة من المُخاط على تلك الأعضاء. ويعتبر هذا المرض أحد أكثر الأمراض الرئوية المزمنة انتشارًا لدى الأطفال والشباب، وهو عبارة عن اضطراب جيني يسبب الوفاة” ، مقتبس من نص ورد على هذا العنوان: https://ar.wikipedia.org/wiki/تليف_كيسي
2- https://www.nature.com/articles/s41586-018-0393-7
3- https://www.cff.org/research-clinical-trials/basics-cftr-protein
4- https://www.science.org/doi/10.1126/science.2772644
5- https://www.ninds.nih.gov/health-information/patient-caregiver-education/brain-basics-life-and-death-neuron#:%7E:text=Neurons%20are%20information%20messengers.,rest%20of%20the%20nervous%20system.
6- https://www.cancer.gov/publications/dictionaries/cancer-terms/def/immune-cell.
7- https://www.penguin.co.uk/books/431895/the-beautiful-cure-by-daniel-m-davis/9781784702212
8- https://www.immunology.org/public-information/bitesized-immunology/cells/natural-killer-cells
9- https://pubmed.ncbi.nlm.nih.gov/24154599/
10- https://ashpublications.org/bloodadvances/article/4/7/1388/454300/Diversity-of-peripheral-blood-human-NK-cells
11- https://www.beckman.com/resources/videos/scientific/introduction-to-flow-cytometry
12- https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/transcriptome
13- https://ar.wikipedia.org/wiki/ترنسكربيتوم
14- https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/transcriptome
15- https://www.nature.com/articles/s41598-020-74567-y
16- https://www.humancellatlas.org/learn-more/
17- https://ar.wikipedia.org/wiki/مخطط_بياني
18- “حديث المصاعد هو استغلال حيز زمني قصير من أجل أن يقدم الشخص نفسه لمشروع معين إلى مدير شركة أو مستثمر محتمل، وهو من أشهر طرق إيصال المعلومات ببلاغة في أدبيات الإدارة. ويقوم على فكرة أنه إذا لم يستطع المرء التعبير عن نفسه في غضون 30 ثانية فقد يهدر فرصًا ثمينة لافتقاره لمهارة «حديث المصاعد»” ، مقتبس من نص ورد على هذا العنوان: https://ar.wikipedia.org/wiki/حديث_المصعد
19- https://www.genome.gov/human-genome-project/What
20- https://ar.wikipedia.org/wiki/عد_دموي_شامل
21- https://www.amazon.co.uk/Secret-Body-Science-Human-Changing/dp/1529110971/
22- https://www.theguardian.com/books/2013/aug/08/compatibility-gene-daniel-davis-review
23- https://www.sciencedirect.com/science/article/pii/S088915911830789X?via%3Dihub

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية