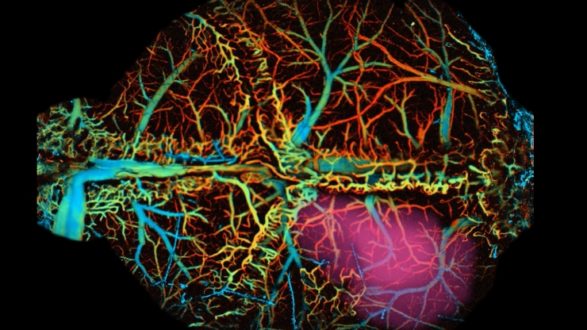
Researchers control brain circuits from a distance using infrared light
(Nicholas Weiler – بقلم: نيكولاس ويلر)
ملخص المقالة:
طور علماء معهد “وو تساي” لعلوم الأعصاب في جامعة ستانفورد أول تقنية غير غازية (غير جراحية) للتحكم في دوائر الدماغ المستهدفة في سلوك الحيوانات من مسافة بعيدة، معتمدة على الأساس الذي وضعه علم البصريات الوراثي، وهي تقنية يتم عن طريقها ادخال بروتينات الطحالب الحساسة للضوء في الخلايا العصبية للسماح للباحثين بتشغيلها أو إيقافها استجابة لألوان مختلفة من الضوء. وتمكن هذه التقنية اختبار وظائف خلايا ودوائر دماغية معينة في عمق الدماغ بمرونة أثناء السلوك الطبيعي – مثل الفئران التي تتواصل بحرية مع بعضها البعض.
( المقالة )
تخيل الدماغ كلوحة مفاتيح عملاقة مغطاة بآلاف الأزرار والمقابض والأقراص والرافعات التي تتحكم في جوانب تفكيرنا وعواطفنا وسلوكنا وذاكرتنا (يمكنك التفكير في فيلم “انسايد أوت” Inside Out، إذا أردت).
ولأكثر من قرن من الزمان، كان علماء الأعصاب يشغلون هذه المفاتيح ويوقفونها بشكل منهجي، بمفردهم أو مجتمعة، لمحاولة فهم كيفية عمل الآلة ككل. ولكن قول هذا أسهل من فعله. وتتشابك الدوائر الخلوية التي تتحكم في العقل والسلوك معا في جميع أنحاء الكتلة غير الشفافة والجيلاتينية لأنسجة المخ ولا تأتي مع مفاتيح تشغيل / إيقاف يدوية لهندسة عكسية سهلة.
والآن، طور العلماء في معهد “وو تساي” لعلوم الأعصاب في جامعة ستانفورد أول تقنية غير غازية (غير جراحية) للتحكم في دوائر الدماغ المستهدفة في سلوك الحيوانات من مسافة بعيدة. والأداة لديها القدرة على حل واحدة من أكبر الاحتياجات غير الملباة في علم الأعصاب: طريقة لاختبار وظائف خلايا ودوائر دماغية معينة في عمق الدماغ بمرونة أثناء السلوك الطبيعي – مثل الفئران التي تتواصل بحرية مع بعضها البعض.

وقد نُشِر البحث في 21 مارس 2022 في مجلة “الهندسة الطبية الحيوية للطبيعية”[١] (Nature Biomedical Engineering) من قبل البروفيسور غوسونغ هونغ وزملاؤه في جامعة ستانفورد وجامعة نانيانغ التقنية في سنغافورة. والبروفيسور هونغ هو باحث في هيئة التدريس في معهد “وو تساي” لعلوم الأعصاب وأستاذ مساعد في علوم وهندسة المواد في كلية ستانفورد للهندسة يستخدم خلفيته في الكيمياء وعلوم المواد لابتكار أدوات ومواد متوافقة حيويا للنهوض بدراسة الدماغ.
وتعتمد التقنية المنشورة حديثا على الأساس الذي وضعه علم البصريات الوراثي، وهي تقنية تم تطويرها لأول مرة في جامعة ستانفورد من قبل كارل ديسيروث العامل لدى معهد “وو تساي” لعلوم الأعصاب والمتعاونين الذين يدخلون بروتينات الطحالب الحساسة للضوء في الخلايا العصبية للسماح للباحثين بتشغيلها أو إيقاف تشغيلها استجابة لألوان مختلفة من الضوء.
وقال البروفيسور هونغ: “لقد كان علم البصريات الوراثي أداة تحويلية في علم الأعصاب، ولكن هناك قيودًا على ما يمكن القيام به بالتقنيات الحالية – ويرجع ذلك جزئيا إلى اعتمادها على الضوء في الطيف المرئي”. وأضاف: “الدماغ غير شفاف تماما للضوء المرئي، لذا فإن توصيل الضوء إلى الخلايا التي تريد تحفيزها يتطلب عادةً غرسات بصرية غازية يمكن أن تسبب تلف الأنسجة وحبل الألياف البصرية المثبتة على الجمجمة والتي تجعل من الصعب دراسة أنواع كثيرة من السلوك الطبيعي”.
وبالتفكير كعالم مواد حول طرق التغلب على هذه التحديات، أدرك البروفيسور هونغ أن الأنسجة الأحيائية – بما في ذلك الدماغ وحتى الجمجمة – شفافة بشكل أساسي لضوء الأشعة تحت الحمراء، مما قد يجعل من الممكن توصيل الضوء أعمق بكثير إلى الدماغ.
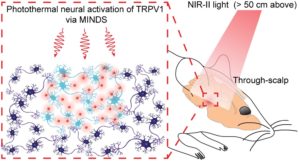
ونظرا لأن الأدوات الوراثية البصرية الحالية لا تستجيب لضوء الأشعة تحت الحمراء، فقد تحول انتباه فريق البروفيسور هونغ إلى جزيء تطور للكشف عن الشكل الآخر للأشعة تحت الحمراء: الحرارة. ومن خلال تجهيز خلايا عصبية محددة بشكل مصطنع في دماغ الفأر بجزيء حساس للحرارة يسمى “تي آر پي ڤي 1”[٢] (TRPV1)، وجد فريقه أنه من الممكن تحفيز الخلايا المعدلة عن طريق تسليط ضوء الأشعة تحت الحمراء من خلال الجمجمة وفروة الرأس من على بعد متر واحد.
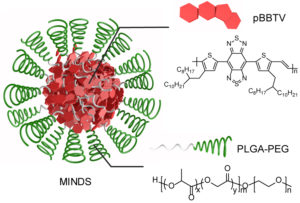
“تي آر پي ڤي 1” هو مستشعر الحرارة الجزيئية الذي يسمح لنا بالشعور بالألم المرتبط بالحرارة – بالإضافة إلى الحرق الحار للفلفل الحار – الذي أدى اكتشافه إلى جائزة نوبل في الطب لعام 2021. ويعطي مستقبل مماثل الثعابين الجرسية وأفاعي الحفر الأخرى “الرؤية الحرارية” التي تسمح لها باصطياد الفرائس ذات الدم الحار في الظلام، ونجحت دراسة حديثة في إعطاء الفئران القدرة على الرؤية في طيف الأشعة تحت الحمراء عن طريق إضافة “تي آر پي ڤي 1” إلى خلاياها المخروطية الشبكية.
وتعتمد التقنية الجديدة أيضا على جزيء “محول الطاقة” المُهَندَس الذي يمكن حقنه في مناطق الدماغ المستهدفة لامتصاص وتضخيم ضوء الأشعة تحت الحمراء الذي يخترق أنسجة المخ. وتعمل هذه الجسيمات النانوية، التي يطلق عليها اسم “مايندس” [(MINDS) لـ “محولات النانو بالأشعة تحت الحمراء الجزيئية لتحفيز الدماغ العميق”(Macromolecular Infrared Nanotransducers for deep-brain Stimulation)]، مثل الميلانين في بشرتنا الذي يمتص الأشعة فوق البنفسجية الضارة من الشمس، وهي مصنوعة من البوليمرات القابلة للتحلل الحيوي المستخدمة لإنتاج الخلايا الشمسية العضوية ومصابيح “الصمام الثنائي الباعث للضوء (إل إي دي)” (Light Emitting Diode (LED)).
وقال البروفيسور هونغ: “حاولنا أولا تحفيز الخلايا بقنوات “تي آر پي ڤي 1″ وحدها، ولم تنجح على الإطلاق”. وأضاف: “اتضح أن الأفاعي الجرسية لديها طريقة أكثر حساسية للكشف عن إشارات الأشعة تحت الحمراء مما يمكننا إدارته في دماغ الفأر. لحسن الحظ، كان لدينا علم المواد لمساعدتنا”.
وأظهر فريق البروفيسور هونغ تقنيتهم لأول مرة بإضافة قنوات “تي آر پي ڤي 1” إلى الخلايا العصبية على جانب واحد من القشرة الحركية للفأر – وهي منطقة تنظم حركات الجسم – وحقن جزيئات “مايندس” في نفس المنطقة. وفي البداية استكشفت الفئران حاوياتها عشوائيا، ولكن عندما فتح الباحثون مفتاح ضوء الأشعة تحت الحمراء فوق العلبة، بدأت الفئران على الفور في المشي في دوائر، مدفوعة بالتحفيز من جانب واحد لقشرتها الحركية.
وقال البروفيسور هونغ: “كانت تلك لحظة رائعة عندما علمنا أن هذا سينجح. بالطبع لم تكن سوى بداية للتحقق من صحة واختبار ما يمكن أن تفعله هذه التكنولوجيا، ولكن من تلك النقطة فصاعدا كنت واثقا من أن لدينا شيئا ما”.
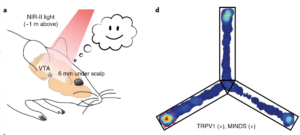
وفي تجربة رئيسية أخرى، أظهر الباحثون أن “مايندس” يمكن أن تمكن من تحفيز الأشعة تحت الحمراء للخلايا العصبية من خلال عمق دماغ الفأر بأكمله. وأدخلوا قنوات “تي آر پي ڤي 1” في الخلايا العصبية التي تعبر عن الدوبامين في مراكز المكافأة في الدماغ، والتي تقع بالقرب من قاعدة الدماغ في الفئران، تليها حقن “مايندس” في نفس المنطقة. ثم وضعوا ضوء الأشعة تحت الحمراء المركز على أحد الأذرع الثلاثة لمتاهة الذراع الشعاعية القياسية وأظهروا أن الفئران أصبحت “مدمنة” على ضوء الأشعة تحت الحمراء غير المرئي الذي يدغدغ خلاياها العصبية الدوبامين – حيث يقضون كل وقتهم تقريبا في المتاهة تحت عوارضها.
وأظهرت هذه التجربة أن التقنية الجديدة تجعل من الممكن تحفيز الخلايا العصبية في أي مكان في الدماغ من خلال فروة الرأس والجمجمة السليمتين – مع بالكاد أي من تشتت الضوء الذي من شأنه أن يجعل هذا مستحيلا مع الضوء في الطيف البصري. ومن اللافت للنظر أن هذا نجح حتى عندما تم وضع شعاع ضوء الأشعة تحت الحمراء حتى متر فوق رؤوس الحيوانات.
ويرى البروفيسور هونغ تطبيقات فورية لتقنية الحركة المتنامية في علم الأعصاب لدراسة دوائر الدماغ المشاركة في السلوك الاجتماعي الطبيعي في الفئران من أجل فهم أفضل للأنظمة التي تكمن وراء الإدراك الاجتماعي لدى البشر.
وقال البروفيسور هونغ: “مثلنا، الفئران من الأنواع الاجتماعية، ولكن دراسة السلوك الطبيعي للحيوان داخل مجموعة اجتماعية تمثل تحديا بحبل الألياف البصرية المثبت على الرأس. يجعل هذا النهج من الممكن لأول مرة تعديل خلايا عصبية ودوائر محددة في الحيوانات التي تتصرف بحرية. يمكن للمرء فقط تسليط ضوء الأشعة تحت الحمراء غير المرئي فوق حاوية مع فئران مشتركة لدراسة مساهمات خلايا ودوائر معينة في سلوك الحيوان داخل مجموعة اجتماعية”.
ويقول إن البروفيسور هونغ والمتعاونين يواصلون صقل هذه التقنية لجعلها أبسط وأسهل في التنفيذ. “في المستقبل، نود الجمع بين نهجنا الحالي المكون من مرحلتين في آلة جزيئية واحدة – ربما عن طريق ترميز بعض الصباغ الممتص للأشعة تحت الحمراء في الخلايا العصبية التي تعبر عن “نقطة تقييم التلفزيون’ [Television Rating Point (TRP)] أنفسهم.
وهذا العمل هو واحد من عدة طرق يشارك فيها البروفيسور هونغ لتمكين الباحثين – وربما الأطباء السريريين في يوم من الأيام – من تعديل الدوائر العصبية بشكل غير جراحي عبر الدماغ. فعلى سبيل المثال، يقوم البروفيسور هونغ وزملاؤه أيضا بتطوير حبات نانوسكوبية يمكنها تحويل الحزم المركزة من الموجات فوق الصوتية إلى ضوء، والتي يمكن حقنها مباشرة في مجرى الدم، مما يجعل من الممكن استهداف الخلايا بصريا وراثيا في أي مكان في الدماغ وتغيير هذا الاستهداف حسب الرغبة في غضون تجربة واحدة.
وقال البروفيسور هونغ: “أعطتنا أساليب التعديل العصبي التقليدية القدرة على قلب عدد قليل من المفاتيح في وقت واحد في الدماغ لمعرفة ما تفعله الدوائر المختلفة. هدفنا هو اتخاذ هذه التقنيات خطوة أخرى لمنحنا سيطرة دقيقة على لوحة المفاتيح بأكملها في نفس الوقت”.
وقد تم تمويل هذا البحث من خلال منحة أولية من معهد “وو تساي” للعلوم العصبية في ستانفورد، وستانفورد بيو إكس، وزمالة ستانفورد للدراسات العليا متعددة التخصصات؛ ومن خلال منحة بدء تشغيل جامعة نانيانغ التكنولوجية وصندوق البحوث الأكاديمية التابع لوزارة التعليم في سنغافورة؛ ومن قبل المؤسسة الوطنية الأمريكية للعلوم (NSF)، والمعهد الوطني للشيخوخة، ومؤسسة ريتا ألين، ومؤسسة الضمور العضلي النخاعي.
*تمت الترجمة بتصرف
المصدر:
ملاحظات:
[أ] المؤلفون المقابلون للدراسة هم البروفيسورغوسونغ هونغ من جامعة ستانفورد والبروفيسور كاني بو من جامعة نانيانغ التكنولوجية، في سنغافورة.
[ب] هدف معهد “وو تساي” للعلوم العصبية هو فهم كيف يؤدي الدماغ إلى الحياة والسلوك العقلي، سواء في الصحة أو في المرض. ويعتمد مجتمعنا البحثي على تخصصات متعددة ويبلغها، بما في ذلك علم الأعصاب والطب والهندسة وعلم النفس والتعليم والقانون. وستغير الاكتشافات التي تنشأ عن هذه التعاون فهمنا للدماغ البشري، وتوفر علاجات جديدة لاضطرابات الدماغ، وتعزز صحة الدماغ طوال العمر.
الهوامش:
[١] تم اطلاق مجلة “الهندسة الطبية الحيوية للطبيعية” (Nature Biomedical Engineering) في يناير 2017، وهي مجلة شهرية عبر الإنترنت فقط تنشر الأبحاث الأصلية والمراجعات والتعليقات ذات الأهمية العالية لمجتمع الهندسة الطبية الحيوية، بما في ذلك علماء مقاعد البدلاء المهتمين باستنباط المواد أو الأساليب أو التقنيات أو العلاجات لفهم الأمراض أو مكافحتها، والمهندسين الذين يقومون بتصميم أو تحسين الأجهزة والإجراءات الطبية، والأطباء الذين يستفيدون من مخرجات البحوث في الهندسة الطبية الحيوية لتقييم صحة المرضى أو تقديم العلاج عبر مجموعة متنوعة من الإعدادات السريرية وسياقات الرعاية الصحية. المصدر: https://www.nature.com/natbiomedeng/journal-information#:~:text=Launched%20in%20January%202017%2C%20Nature,or%20therapies%20to%20understand%20or
[٢] العضو الفرعي لقناة الكاتيون المحتملة للمستقبلات العابرة V 1″ (TrpV1)”، المعروف أيضا باسم مستقبلات الكابسيسين ومستقبلات الفانيليا 1، هو بروتين يتم ترميزه في البشر بواسطة جين (TRPV1). كان أول عضو معزول في بروتينات مستقبلات الفانيليا المحتملة العابرة التي بدورها عائلة فرعية من مجموعة البروتين المحتملة للمستقبلات العابرة. هذا البروتين هو عضو في مجموعة (TRPV) من عائلة المستقبلات العابرة المحتملة للقنوات الأيونية. وظيفة (TRPV1) هي الكشف عن درجة حرارة الجسم وتنظيمها. بالإضافة إلى ذلك، يوفر (TRPV1) إحساسا بالحرارة الحارقة والألم (استقبال الألم). في الخلايا العصبية الحسية الواردة الأولية، تتعاون مع (TRPA1) (مستقبلات مهيجة كيميائية) للتوسط في الكشف عن المحفزات البيئية الضارة. ويكيبيديا.

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية