Pfizer unveils its oral SARS-CoV-2 inhibitor
The antiviral candidate is the first orally administered compound to enter clinical trials that targets the virus’s main protease
ما خلف كواليس حملة الكيمياء الدوائية التي أدت إلى الوصول الى حبوب (Paxlovoid)
(بقلم: بيثاني هالفورد – Bethany Halford)
مقدمة المترجم:
تطوير أدوية مضادة للفيروسات شكّل تحدياً هائلاً لخبراء الكيمياء الدوائية ، وجائحة كورونا قد تكون سبباً مهماً في كسر هذا التحدي.
الفيروسات مخادعة. فهي صغيرة الحجم، بسيطة التصميم، وتتكاثر بسرعة وتنتج ملايين النسخ من نفسها كل يوم. أو بالأحرى ، تنتج الخلايا المصابة بها تلك النسخ الجديدة من الفيروس. وعندما يتعلق الأمر بالعثور على العقاقير التي يمكن أن تقتل الفيروس، فهذا جزء من المشكلة: ليس للفيروسات الكثير من البروتينات والإنزيمات الخاصة بها لاستهدافها. ومع قلة الأهداف الجيدة للأدوية والحوافز المالية المحدودة ، تأخر كثيراً مجال اكتشاف الأدوية المضادة للفيروسات.
لذا، حتى عند تطوير دواء ضد فيروس ما، فمن غير المرجح إمكانية استخدامه لعلاج فيروس آخر. إضافة إلى نقص النماذج الحيوانية الموثوقة ونقص الاستثمار، يصبح من الواضح أن تطوير الأدوية المضادة للفيروسات مشكلة معقدة.
لعقود من الزمان ، لم يعرف العلماء ما إذا كانت الفيروسات لديها أي من الإنزيمات الخاصة بها. افترض الباحثون أن الخلايا المصابة، قامت ببناء نسخ جديدة من الفيروس باستخدام الإنزيمات والبروتينات الخاصة بالخلايا. ثم في عام 1967 ، اكتشف العلماء أول إنزيم فيروسي ، وهو (Polymerase) بوليميريز الحمض النووي الريبي المعتمد على الحمض النووي لفيروس الجدري.
نظرًا لأن الفيروسات ترمز إلى عدد قليل من البروتينات الخاصة بها ، فقد يكون هناك بروتين واحد أو اثنين فقط يمكن للدواء استهدافهما. وقد يكون لتلك الإنزيمات الفيروسية وظائف تؤديها الخلايا المضيفة أيضًا. هذا التداخل يخلق احتمالية أن يتسبب أحد مضادات الفيروسات عن غير قصد في إلحاق الضرر بالخلايا البشرية السليمة.
لا تقتصر تحديات اكتشاف الأدوية المضادة للفيروسات على تصميم مثبط جيد. بل تتعدى إلى إظهار أن العقار يعمل – أولاً في الخلايا ، ثم في الحيوانات ، وأخيراً في البشر. لكن يمكن للنماذج الخلوية والحيوانية أن تمثل عقبات جديدة للباحثين العاملين على الفيروسات. على سبيل المثال ، كافح الباحثون لسنوات، لجعل التهاب الكبد C يتكاثر في الخلايا في المختبر. حل العلماء هذه المشكلة بعد أن خلقت البيولوجيا التركيبية الذكية الحمض النووي الريبي الفيروسي ذاتي التكاثر من فيروس التهاب الكبد C ، مما سمح لهم بدراسة كيفية تأثير تعطيل البروتينات الفردية على دورة الحياة الفيروسية. وبمجرد أن يوقف الدواء الفيروس في الخلايا في طبق بتري ، يحتاج العلماء إلى اختباره في نماذج حيوانية موثوقة، يمكن أن تعطي نتائج ذات صلة من الناحية الفسيولوجية.
ليس من المستغرب أن العالم انتبه فجأة الى عدم وجود مضادات فيروسات جديدة ، وظهر ذلك جلياً في نقص خيارات العلاج لـ (COVID-19).
كان يعتقد العلماء، أنه بعد مرور عام على انتشار الوباء، أن الكثير من الجزيئات الصغيرة سوف تتسلل إلى السوق ، لكن الأمر ليس بالقدر المأمول.
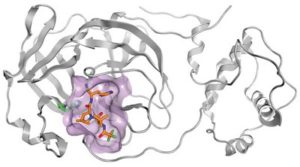
لكن الجائحة من جهة أخرى، هيأت الظروف المواتية والتمويل اللازم والزخم المتواصل، لتطوير مضادات فيروسات جديدة، وبفضل تقدم البيولوجيا الجزيئية والتقنيات المتقدمة الأخرى، أمكن العلماء من استخدام تقنيات متطورة جداً في عملية تطوير الأدوية مثل تقنية دراسة البلورات بالأشعة السينية (crystallography). تعد دراسة البلورات بالأشعة السينية الكبيرة الجزيئية تقنية مهمة وقوية في اكتشاف الأدوية ، تستخدمها شركات الأدوية في عملية اكتشاف الأدوية الجديدة. حيث يسمح التحليل التفصيلي للتركيبات البلورية لمجموعة البروتين – الترابط بدراسة التفاعلات المحددة لدواء معين مع هدفه البروتيني على المستوى الذري. بحيث يستخدم لتصميم الأدوية وتحسينها. وهذا ماقامت به شركة فايزر في تطويرها لعقار باكسلوفيد حيث استغلت الشركة التقنيات التابعة لمختبر أرجون الوطني التابع لوزارة الطاقة الامريكية، والذي تضم مايعرف بمصدر الفوتون المتقدم (Advanced Photon Source) والذي يطلق عليه اختصاراً (APS) وكان لها دور مهم في مساعدة علماء فايزر على تطوير دواء باكسلوفيد.
فبمساعدة الأشعة السينية (اشعة-اكس) فائقة السطوع في (APS) جرى فحص بروتينات فيروس (SARS-CoV-2) المسبب لكوفيد-19 واختبار الهيكل البنائي (structure) للمضاد الفيروسي نيرماتريلفير (nirmatrelvir) الذي يشكل المادة الفعالة الرئيسية في دواء باكسلوفيد.
هذا المقال المترجم يسرد قصة تطوير عقار جديد لعلاج كوفيد من دواء قديم باستخدام تقنية ثورية وواعدة.
( نص المقال المترجم )
نظرًا لارتفاع حالات الإصابة بفيروس (COVID-19) في جميع أنحاء العالم بسبب متغير (Omicron) شديد العدوى ، يأمل الأطباء في أن يكون (Paxlovid) ، وهو علاج (Pfizer) الفموي لـ (COVID-19) ، شريان الحياة بالنسبة للبعض.
على الرغم من نقص المعروض حاليًا ، إلا أن مضاد الفيروسات أظهر نتائج واعدة للغاية في التجارب السريرية: مقارنةً بالدواء الوهمي ، فقد قلل من خطر دخول المستشفى أو الوفاة من (COVID-19) بنسبة 88٪ إذا تم إعطاؤه في غضون 5 أيام من ظهور الأعراض.
بناءً على هذه البيانات ، منحت إدارة الغذاء والدواء الأمريكية تصريح استخدام (Paxlovid) في حالات الطوارئ أواخر الشهر الماضي ، وأمرت الحكومة الفيدرالية بالحصول على ما يكفي من مضاد الفيروسات لعلاج 20 مليون شخص حتى عام 2022. أعلنت شركة (Pfizer) أنها تخطط لإنتاج 120 مليون دورة علاجية لهذا الغرض. العام وستسعى للحصول على الموافقة التنظيمية الكاملة لمضاد الفيروسات.
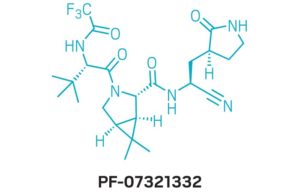
يُعد وجود (Paxlovid) رائعًا ، مع الأخذ في الاعتبار أن المكون المضاد للفيروسات – الذي كان يُطلق عليه في الأصل (PF-07321332) والذي أطلق عليه مؤخرًا اسم (nirmatrelvir) – لم يكن حتى رسمًا تخطيطيًا في دفتر مختبر الكيمياء الطبية قبل عامين. انتقل الدواء المضاد للفيروسات من فكرة إلى أول اختبار سريري على شخص خلال 12 شهرًا – وهي وتيرة مذهلة يتم من خلالها تقديم دواء موصى به حسب الطلب.
بدأت قصة اكتشاف الدواء يوم الجمعة ، 13 مارس 2020 ، عندما أُرسل الكيميائي الدوائي دافيد أوين إلى منزله من وظيفته في شركة فايزر في كامبريدج ، ماساتشوستس. مثل العديد من أرباب العمل في ذلك الوقت ، كانت شركة الأدوية العملاقة توقف معظم العمليات في الموقع في مواجهة حالة الطوارئ الوطنية بسبب (COVID-19). طلب رؤساء أوين منه قضاء عطلة نهاية الأسبوع، في التفكير في الموارد التي سيحتاجها لقيادة برنامج لتطوير عقار عن طريق الفم لمكافحة الوباء المستجد. لقد كان اختيارًا غير عادي من بعض النواحي: لم يعمل أوين مطلقًا على مضاد للفيروسات ولم يكن أبدًا قائد مشروع.
أمضى أوين كامل حياته المهنية في شركة فايزر. بدأ العمل في موقع الشركة بإنجلترا ساندويتش في 1999 وانتقل إلى الولايات المتحدة في 2011. على مدى العقد الماضي ، كما يقول ، كان دوره هو المساعدة في اختيار أهداف لبرامج الكيمياء الدوائية. لقد ساعد في إطلاق حملات في علم الأورام وإدارة الألم وأمراض القلب والأوعية الدموية. يقول: “أردت أن أبدأ البرامج الصحيحة ، والتي أعتقد أنها جزء مهم من عملية صنع القرار الجيد في شركات الأدوية الكبرى”.
لكن أوين يقول إنه كان سعيدًا بتولي قيادة البرنامج لمضادات الفيروسات الفموية. قد تكون مكانته كقائد مشروع مبتدئ قد منحته ميزة. يقول: “أُعدنا جميعًا إلى الوطن يوم الجمعة ، وكان العالم مختلفًا تمامًا”. كانت هناك درجة معينة من الإلحاح ، وبعد أن لم يسبق لقيادة مشروع اكتشاف دواء من قبل ، لم يشعر أوين بأنه ملزم بأي مفاهيم مسبقة حول كيفية تشغيل مثل هذا البرنامج.
خلال عطلة نهاية الأسبوع ، ركز أوين على الكيمياء المضادة للفيروسات. في هذه الحالة ، لم يكن مضطرًا لاختيار الهدف. عرف علماء شركة (Pfizer) أنهم يريدون صنع مضاد للفيروسات يلاحق البروتياز الرئيسي (المعروف أيضًا باسم البروتياز 3CL) لـ (SARS-CoV-2) – الفيروس التاجي الذي يسبب (COVID-19). كان منع البروتياز الفيروسي استراتيجية ناجحة لتطوير الأدوية التي تكافح فيروس نقص المناعة البشرية والتهاب الكبد سي. بينما لا توجد مقارنة مباشرة بين هذين الفيروسين و (SARS-CoV-2) ، يقول أوين إنها كانت استراتيجية سليمة.

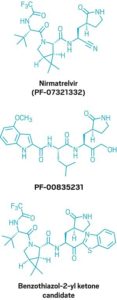
علاوة على ذلك ، كان لدى شركة (Pfizer) زمام المبادرة بالفعل. في عام 2003 ، طور باحثون في الشركة مضادًا للفيروسات ، يُعرف باسم (PF-00835231) ، يمكنه منع البروتين الرئيسي لفيروس كورونا الذي ظهر في عام 2002 ويسبب متلازمة الجهاز التنفسي الحادة الوخيمة (سارس). ولكن بحلول الوقت الذي كانوا فيه مستعدين لاختباره على المرضى ، تم احتواء تفشي السارس. يشبه (PF-00835231) من الناحية الهيكلية الببتيد الذي يرتبط بالبروتياز الرئيسي للسارس. موقع الارتباط في السارس مماثل لذلك الموجود في (SARS-CoV-2) ، لذلك اعتقد باحثو (Pfizer) أن الجزيء يمكن أن يعمل ضد الفيروس الجديد. أظهرت الاختبارات أنهم كانوا على حق.
ولكن ببنيته الشبيهة بالببتيد ، فإن (PF-00835231) غني بمانحي الروابط الهيدروجينية. له خمسة منهم ، ويمنحون الجزيء مساحة سطح قطبية تحبسه في القناة الهضمية إذا ابتلع. هذا يعني أنه يجب إعطاء الجزيء عن طريق الوريد – وهو أمر لا يمكن إجراؤه عادةً إلا في المستشفى. أراد علماء شركة (Pfizer) الحصول على حبوب منع الحمل المضادة للفيروسات التي يمكن للناس تناولها عند ظهور العلامات الأولى للعدوى ، قبل وقت طويل من اضطرارهم إلى الذهاب إلى المستشفى.
التحدي الذي واجهه أوين وزملاؤه: العثور على جزيء يمكن تناوله عن طريق الفم. يقول أوين: “هذه مشكلة كيميائية”. بعد عطلة نهاية الأسبوع من تخطيط الاستراتيجيات ، كان لديه هو وزملاؤه خطة ، وبحلول يوم الاثنين ، 16 مارس 2020 ، كان برنامجهم لمضادات الفيروسات الفموية قيد التنفيذ. لن يعود أوين إلى مكتبه في كامبريدج حتى أبريل 2021. سيقضي 13 شهرًا القادمة في العمل في مكتب مؤقت في منزله ، حيث يحصل على لمحة عرضية عن الحياة البرية على سطحه بينما كان أطفاله يتنقلون في التعليم عن بعد.
كان أحد الأجزاء الرئيسية لإستراتيجية الكيميائيين هو القضاء على بعض مانحي روابط الهيدروجين الذين يحتفظون بـ (PF-00835231) في القناة الهضمية. يقول أوين إن الفريق اتبع نظاماً منهجيًا ، واستجوب كل رابطة هيدروجينية. يقول أوين: إذا كانت رابطة هيدروجين معينة ضرورية لجعل المركب يرتبط بالبروتياز ، فإنه يجب أن يبقى في الجزيء. “كنا نبحث عن روابط هيدروجينية يمكننا التخلص منها دون أن نفقد فاعلية مضادات الفيروسات”.
كان أول مانح برابطة هيدروجينية قام الفريق بإزالته من (PF-00835231) هو (α-hydroxymethyl ketone). يتفاعل هذا الموقع تساهميًا مع السيستين في البروتياز الرئيسي ، لذلك اعتقد الكيميائيون أنه يمكنهم استبداله بمجموعة تفاعلية مختلفة لم تكن متبرعًا برابطة الهيدروجين. لقد اختاروا متابعة سلسلتين من المركبات: أحدهما يحتوي على (benzothiazol-2-yl ketone) كمجموعة تفاعلية والآخر يحتوي على مجموعة تفاعلية من النتريل. لن يكون حتى قرب نهاية الحملة التي اختارها الكيميائيون بين الاثنين.
مانح آخر لرابطة الهيدروجين أدرك الكيميائيون أنه يمكنهم التخلص منه كان في جزء ليسين (PF-00835231). قرروا استبدال هذا الجزء بحمض أميني دوري من شأنه القضاء على رابطة (N – H). يقول أوين: “بمجرد أن تجعله دوريًا ، لا يزال يتعين أن يبدو مثل الليوسين ، لأن البروتياز يتوقع رؤية الليوسين في هذا الموضع”. لتحقيق ارتباط يشبه الليوسين ، يتميز النموذج أيضًا بحلقة سايكلوبروبيل مدمجة مع مجموعتين من الميثيل. اقترحت الدراسات الحسابية أن الهيكل سوف يدخل في موقع الربط. وكانت هناك سابقة لهذا الحافز: فقد استخدمه علماء شيرينغ بلاو في مادة بوسبريفير المضادة لفيروس التهاب الكبد الوبائي سي.
يقول أوين: “صنع الحلقات هو نوع من الإزدهار أو الإنهيار في الطب الكيميائي”. “إما أن تربح بشكل كبير أو تخسر الكثير ، لأنك تقوم فقط بأخذ عينات من شكل واحد عندما تذهب إلى جزيء دوري. لذلك كان من الأفضل أن يكون هذا التشكل صحيحًا ، وإلا فسينتهي بك الأمر إلى جزيء غير نشط”. بينما لاحظ الكيميائيون انخفاضًا طفيفًا في الفاعلية عندما أدخلوا العنصر الدوري إلى جزيئهم ، يقول أوين إنه لم يكن كافيًا لقتل نشاط المركب — لذلك أصبح الجزء الدوري سمة مهمة.
لكن إزالة مانح الرابطة الهيدروجينية كانت لها تكلفة أيضًا – فقد الفريق اتصالاً حرجًا بالجليسين في جيب ربط البروتياز. في محاولة لاستعادة هذا التفاعل مع هذا الحمض الأميني ، استبدل الكيميائيون في عدة مجموعات مختلفة بشق إندول (PF-00835231) – تجربة ميثان سلفوناميد وأسيتاميد وثلاثي فلورو أسيتاميد. تبدو هذه الجزيئات الثلاثة متشابهة ، وتتوقع أن تتصرف بشكل مشابه. لكن لم يكن هذا هو الحال على الإطلاق. برز ثلاثي فلورو أسيتاميد في قدرته على اختراق حاجز القناة الهضمية في المقايسات.
لن يكون ثلاثي فلورو أسيتاميد هذا الخيار الأول لمعظم الكيميائيين الطبيين ، وفقًا لجيريمي جرين ، الكيميائي المخضرم والاستشاري المضاد للفيروسات الذي لم يشارك في المشروع. يقول جرين: “لكن يبدو أن هذا يمنح حقًا النفاذية التي كانوا يبحثون عنها”.
يقول أوين إن اليوم الذي أدركوا فيه تأثير ثلاثي فلورو أسيتاميد كان يومًا مهمًا. “تمكنا بعد ذلك من دمج ذلك مع التغييرات الأخرى التي أجريناها ، معتقدين أنه قد يكون لدينا طريقة لتأمين التوافر البيولوجي الشفوي الذي كان حاسمًا لتقديم وكيل شفهي”.

أخيرًا ، كان على الكيميائيين أن يختاروا بين مجموعاتهم التفاعلية – كيتون البنزوثيازول 2-يل والنتريل. بدا كلا الجزيئين واعدًا ، كما يقول أوين ، ولكن “عندما كان كلاهما في متناول اليد ، تمكنا من التمييز بين الاثنين”. اختاروا النتريل بسبب ثلاثة اختلافات رئيسية. أولاً ، كان النتريل أكثر قابلية للذوبان من (benzothiazol-2-yl ketone). يشرح أوين أنه كلما كان الجزيء أكثر قابلية للذوبان ، كان من الأسهل صنع محاليل عالية التركيز للجزيء المطلوب لدراسات علم السموم قبل السريرية.
هناك عامل آخر كان على الكيميائيين مراعاته وهو أن كلا المجموعتين التفاعليتين تقعان بجوار هيدروجين غير متناظر يمكن أن يتخلل ، وأن كيتون البنزوثيازول 2-يل كان أكثر عرضة للتخبط من النتريل. أخيرًا ، كما يقول أوين ، كانت هناك مسألة التوسع. يقول: “بصراحة ، طريقة صنع النتريل أسهل كثيرًا من البنزوثيازول -2-يل كيتون على نطاق واسع”. “لا يوجد فرق كبير في مختبر مقياس الاكتشاف. ولكن إذا كنت تعتقد أن التصنيع في مستقبلك ، فإنه يحدث فرقًا كبيرًا “.
في 22 يوليو 2020 ، صنع كيميائيو شركة (Pfizer) العقار (PF-07321332) – والذي سيعرف في النهاية باسم (nirmatrelvir) – لأول مرة. يقول أوين: “كان هذا مجرد واحد من بين 20 مجمعًا صنعناها في ذلك الأسبوع”. “لم نكن نعرف ما كان لدينا في ذلك الوقت”.
ضم الجزيء جميع التعديلات الاستراتيجية التي توصل إليها الكيميائيون لجعله مضادًا قويًا للفيروسات ومركبًا يمكن تناوله على شكل أقراص. لم يكن حتى صباح 1 سبتمبر 2020 – عندما عادت نتائج دراسة الحرائك الدوائية على الفئران – أدرك الباحثون أنهم يسيرون على الطريق الصحيح.
قبل بضعة أسابيع ، أظهروا أن (PF-07321332) لديه نشاط جيد مضاد للفيروسات (SARS-CoV-2) ، وأكدت دراسة الفئران أنه يمكن إعطاء المركب عن طريق الفم. يقول أوين إنه لا تزال هناك طرق يجب اتباعها قبل أن يعرفوا ما إذا كان (PF-07321332) مرشحًا فعالاً للأدوية ، ولكن ذلك الصباح الباكر من سبتمبر كان يومًا مثيرًا للفريق.
من هناك ، سرعان ما قام الكيميائيون في شركة (Pfizer) بتوسيع توليفهم لـ (PF-07321332) ، وقدموا 1.4 كجم من المركب لدراسات السموم بحلول أوائل نوفمبر 2020. نظرًا لأن الجزيء يحاكي الببتيد ، كما يقول أوين ، فإن تركيبه يتلخص أساسًا في التقاط روابط أميد معًا. ويلاحظ أن هناك بعض مواد البداية المعقدة في (PF-07321332) – التركيب ثنائي الحلقات واللاكتام ، وهو الجزء الوحيد من الجزيء المتبقي من (PF-00835231). يقول أوين إن الفريق أنشأ بالفعل سلسلة إمداد جيدة للمكون الأخير.

لجعل المرشح المضاد للفيروسات (Paxlovid) ، قام الفريق بدمج (PF-07321332) مع ريتونافير المضاد لفيروس نقص المناعة البشرية. يقول أوين إن هذا النهج كان أحد الأساليب التي اعتقد الباحثون أنه قد يتعين عليهم اتباعها منذ بداية المشروع. ليس لـ (Ritonavir) أي نشاط ضد (SARS-CoV-2) ولكنه يرتبط باستقلاب الإنزيمات ، وبالتالي يمنع (PF-07321332) من الانهيار قبل أن يؤدي وظيفته في التخلص من البروتياز الرئيسي للفيروس.
المستشار جيريمي جرين يصف تطوير (PF-07321332) بأنه مثير للإعجاب. يقول: “لقد ساروا بسرعة وبعيدًا في فترة زمنية قصيرة”. يقول جرين إنه في مجال البروتياز ، يمكن أن يكون الحصول على مركبات منفذة للأمعاء أمرًا صعبًا ، لا سيما عندما تبدو الجزيئات مثل الببتيدات ، كما يفعل (PF-07321332).
يقول أوين إنه في هذه المرحلة ، ساعد آلاف الأشخاص في شركة فايزر في جلب باكسلوفيد للمرضى. أما فيما يتعلق باكتشاف (PF-07321332) ، كما يقول ، فإن العلماء في العديد من التخصصات قد أتوا بالمشروع. يقول أوين: “إنه لأمر رائع حقًا كيف يمكن للشركات الدوائية أن تجمع هذه الأشياء معًا ، حيث يلعب الأشخاص أدوارهم الخبيرة ، ويحققون أفضل ما لديهم على الإطلاق”. “لحسن الحظ ، لدينا شيء نظهره لذلك”.
*تمت الترجمة بتصرف
**غسان علي بوخمسين ، صيدلاني أول ، مستشفى جونز هوبكنز.
المصدر:
 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية
