تعد تقنية كريسبر أداة قوية لتحرير الجينوم، مما يعني أنها تتيح للباحثين تغيير تسلسل الحمض النووي بسهولة وتعديل وظيفة الجين. له العديد من التطبيقات المحتملة، بما في ذلك تصحيح العيوب الوراثية، وعلاج الأمراض ومنع انتشارها، وتحسين نمو المحاصيل ومرونتها. ومع ذلك، على الرغم من وعود التكنولوجيا، فإنها تثير أيضًا مخاوف أخلاقية.

في الاستخدام الشائع، تعد “CRISPR” (تُنطق “crisper”) اختصارًا لـ “CRISPR-Cas9”. إن كريسبر عبارة عن امتدادات متخصصة من الحمض النووي، والبروتين (Cas9) – حيث يرمز كاس إلى “مرتبط بـ CRISPR” – هو إنزيم يعمل مثل زوج من المقص الجزيئي، القادر على قطع خيوط الحمض النووي.
أصبحت القدرة على إدخال الجينات أو إزالتها بشكل انتقائي من الحمض النووي منتشرة على نطاق واسع وبالكاد يمكن أن يكون السؤال أكثر عمقًا ، وهو بعد أن عثر العلماء على وسيلة بسيطة لإجراء تغييرات دقيقة وبالأخص على قانون الحياة، والسؤال الذي يطرح نفسه: هل ينبغي للبشر أن يتحكموا في مصيرهم الجيني، ويعيدوا كتابة الحمض النووي للأجيال القادمة؟
لصياغة إجابة، أو على الأقل إيجاد أرضية مشتركة، عقدت مجموعة دولية من الخبراء في واشنطن العاصمة قمة مدتها ثلاثة أيام. عقد الاجتماع مع بعض الاستعجال من قبل الأكاديميات الوطنية الأمريكية، والمملكة المتحدة، والصينية، ووصف الاجتماع بأنه “مناقشة عالمية” وإنه فرصة لتقييم التكنولوجيا الثورية التي لديها القدرة على فعل الخير، وأيضا إمكانية إحداث الفوضى على حد سواء.
؛؛وبمجرد استكشاف الفكرة في الخيال فقط، فانه أصبح الاحتمال الآن حقيقيًا مما أدى الى الارتفاع الحتمي في تحرير الجينات ووضع التكنولوجيا في المختبرات في جميع أنحاء العالم والتي أجرت التجارب الأولى على الأجنة البشرية، في محاولة لتصحيح الجينات المعيبة التي تسبب المرض؛؛
يقول رالف سيسيرون، رئيس الأكاديمية الوطنية الأمريكية للعلوم، حيث ستُعقد القمة: “تنتشر هذه التقنية الجديدة لتحرير الجينات، أي الإدخال الانتقائي للجينات وإزالتها من الحمض النووي للكائن الحي، في جميع أنحاء العالم”. ويضيف أنه مع تضخم عدد التجارب، يجب العمل على الاستخدامات والمخاطر التي تجلبها التكنولوجيا الآن.
كانت آخر مرة التقى فيها العلماء بهذا الشكل في عام 1975، عندما أصبح واضحًا أن الحمض النووي من نوع ما يمكن أن ينقسم إلى نوع آخر. كانت إحدى التجارب التي كانت جارية في ذلك الوقت تهدف إلى وضع الحمض النووي من فيروس القردة المسبب للسرطان في البكتيريا التي تصيب البشر. أدت احتمالية وقوع كارثة إلى اجتماع في أسيلومار (Asilomar)* بكاليفورنيا للاتفاق وتقديم ضمانات جديدة للتجارب.
وقالت جينيفر دودنا، مخترعة أداة تعديل الجينات تسمى (Crispr-Cas9) ، إن (Asilomar) كان في ذهنه كثيرًا عندما تم تنظيم القمة. تقول: “أعتقد أنها نسخة هذا الجيل من (Asilomar)”. “إنه وقت مثير للغاية، ولكن كما هو الحال مع أي تقنية قوية، هناك دائمًا خطر أن يتم القيام بشيء ما إما عن قصد أو عن غير قصد وله آثار سيئة بطريقة أو بأخرى”.
وفي العديد من البلدان، بما في ذلك المملكة المتحدة، من غير القانوني إجراء تعديل وراثي على جنين بشري مقدر له أن يصبح إنسانًا. هذا الإجراء، المعروف باسم تعديل الخط الجرثومي، محفوف بالمعضلات حيث يظهر تعديل الحمض النووي للجنين والتغييرات في كل خلية في الجسم البالغ ويتضمن ذلك الحيوانات المنوية والبويضات، وبالتالي فإن التغييرات الجينية وأي آثار جانبية غير متوقعة ان تنتقل إلى الأجيال القادمة.
ومن بين العلماء الذين حضروا الاجتماع، هناك العديد ممن يترددون في عدم الإفصاح مطلقًا عن التعديل الوراثي للأجنة. وهم يجادلون بأن هذا الإجراء يمكن أن يمنع الاضطرابات الوراثية المدمرة مثل تاي ساكس من الانتقال.
من الناحية المستقبلية، يمكن لهندسة الأجنة مقاومة الأمراض، أو إزالة الجينات التي تزيد من خطر الإصابة بالسرطان والخرف.
يقول السير جون سكيل ، الذي سيمثل الجمعية الملكية: “لا أريد أن أرسم خطوطًا حمراء في هذه المرحلة” ، ويقول (Cicerone) إنه يريد أن يسمع من مجموعات المرضى قبل اتخاذ قراره. واما بالنسبة إلى دودنا، التي دعت إلى التوقف الاختياري في الماضي، فقالت: “من السابق لأوانه وربما ليس عمليًا رسم خط أحمر”، لكنها تقول إنه لا يُعرف سوى القليل جدًا عن السلامة والفعالية للنظر فيهما اليوم.
ابتكر العلماء مجموعة من الأدوات لتعديل الحمض النووي، ولكن الأكثر شيوعًا هو (Crispr-Cas9). إنه يعمل مثل وظيفة البحث والاستبدال في معالج النصوص، أولاً تحديد الجين المراد تحريره، ثم إجراء التغيير اللازم.
؛؛لقد تم استخدامه لمجموعة محيرة من الاستخدامات: إعادة خلق الأمراض الوراثية في الحيوانات، وجعل المحاصيل أكثر صلابة، وتصميم خلايا بشرية مقاومة لفيروس نقص المناعة البشرية، وخلق بعوض معدل وراثيًا (GM) لا يمكنه نشر الملاريا؛؛
وفي المؤتمر أبلغ الفريق الصيني عن المحاولة الأولى مع (Crispr-Cas9) لتعديل الحمض النووي للأجنة البشرية لتصحيح العيوب الجينية وراء اضطراب دم نادر ولكنه قاتل في كثير من الأحيان يسمى بيتا ثلاسيميا. وكذلك تقدمت مجموعة بحثية بريطانية بطلب للحصول على إذن لتعديل الأجنة البشرية لأغراض البحث في المملكة المتحدة، حيث يمكن دراسة الأجنة المتبرع بها لمدة 14 يومًا ثم تدميرها.
قال مارسي دارنوفسكي ، مدير مركز علم الوراثة والمجتمع ، والمتحدث في القمة ، إن الاجتماع يمكن أن يقدم مساهمة حقيقية في النقاش ، ولكن يجب أن يكون أكثر شمولاً. “الأمر المقلق هو أن المنظمين ينتمون إلى ثلاث مناطق من العالم حيث يبدو أن هناك، على الأقل، بين العلماء، الحماس الأكبر للمضي قدمًا”.
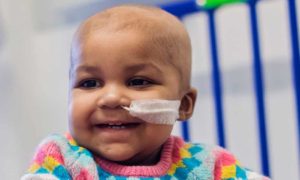
يريد دارنوفسكي حظرًا تامًا على تحرير الأجنة البشرية المقدر لها أن تصبح بشرًا. “إنها طريقة محفوفة بالمخاطر للغاية ومن المرجح أن تظل على هذا النحو”، كما تقول. وتقول إنه إذا سُمح بالتحرير لمنع انتقال الأمراض، فسيؤدي ذلك بسرعة إلى أطفال مصممي الأزياء. يقول الناس إنه منحدر زلق. أنا لا أسمي ذلك منحدرًا زلقًا، بل أسميه القفز من جرف”.
“سنكون على الطريق الصحيح نحو عالم يحاول فيه الأشخاص الذين يمكنهم تحمل تكاليف ذلك منح أطفالهم أفضل بداية في الحياة، وستبدأ الضغوط التنافسية والتجارية. سننتهي في عالم مليء ممن يملكون وممن لا يملكون الجينات، ويخاطرون بإدخال أنواع جديدة من عدم المساواة عندما يكون لدينا بالفعل الكثير بشكل مخجل”.
متحدثة أخرى، هيلي هاكر، عالمة اللاهوت الكاثوليكية بجامعة لويولا في شيكاغو، تريد فرض حظر مؤقت على تعديل الأجنة البشرية لأغراض البحث الأساسي، و “حظرًا صارمًا” على أي عمل يؤدي إلى زرع أجنة معدلة وراثيًا في النساء.
إن اعتراضها لا ينبع من قدسية الحياة البشرية. إنها تخشى أن تخضع النساء وأطفالهن لمراقبة مكثفة من قبل العلماء، حتى يصبح الأطفال بالغين. وتجادل بأن هذا العبء غير مقبول. إن أبسط علاج للزوجين الملتزمين بنقل مرض وراثي هو استخدام التبرع بالحيوانات المنوية والتشخيص المسبق للزرع لاختيار أجنة أطفال الأنابيب الصحية، كما تقول. وتجادل بأن الرغبة في إنجاب أطفال مرتبطين وراثياً لا ينبغي أن تكون ورقة رابحة.
يقول سيسيرون إن الاجتماع قد لا يتوصل إلى إجماع، لكنه يأمل في بعض الاتفاق في المجالات الرئيسية، مثل ما هو مفيد للمجتمع. كما هو الحال مع أبحاث الخلايا الجذعية، قد تتوصل البلدان المختلفة إلى استنتاجات مختلفة، كما يقول. ويضيف: “هذه أسئلة معقدة”. “قد يستغرق الأمر اجتماعات أخرى”.
بينما شهد منتصف القرن العشرين تسابق القوى العظمى في العالم لاستكشاف الفضاء، تدور المنافسة العالمية الأولى في هذا القرن في ساحة أصغر بكثير وهو حمضنا النووي.
لمحة تاريخية عن الهندسة الوراثية
حتى لو مرت فترة منذ آخر فصل لعلم الأحياء، فمن المحتمل أنك تعلم أن معظم الكائنات الحية تمتلك الحمض النووي. تحتوي هذه الخيوط الصغيرة من الجزيئات على جميع معلوماتنا الجينية. إنهم يحددون شكلنا، وكيف تعمل أجسادنا، وكل شيء آخر يجعل كائناً حياً على ما هو عليه.
منذ سبعينيات القرن الماضي، كان العلماء يستكشفون طرقًا لمعالجة الحمض النووي ولقد تعلموا كيفية قطع الأجزاء الصغيرة، ووضع أجزاء من التعليمات البرمجية، وإعادة صياغة هذه الجزيئات بشكل عام لتناسب احتياجاتنا.
في عام 1974، ابتكروا فئرانًا معدلة وراثيًا، مما أدى إلى تحسين قدرة الباحثين على إجراء الاختبارات الطبية وفي عام 1982، ظهرت البكتيريا المعدلة لإنتاج الأنسولين في السوق، مما يلغي الحاجة إلى الحصول عليها من الحيوانات. ومنذ عام 1994، كانت متاجر البقالة تحمل محاصيل معدلة وراثيًا، مما يتيح لنا الوصول إلى أغذية أفضل من الناحية التغذوية تدوم طويلاً.
بقدر ما كان كل هذا ثوريًا، فقد كانت الهندسة الوراثية تقليديًا باهظة الثمن ومعقدة وتستغرق وقتًا طويلاً بشكل ملحوظ حتى جاءت تقنية “كريسبر”.
كشف كريسبر
في أواخر الثمانينيات من القرن الماضي، لاحظ العلماء أجزاء متكررة قليلة من تسلسل الحمض النووي التي كانت متناظرة (من الأمام إلى الخلف). كان وجودها غير معتاد، وقد أطلقوا عليهم “التكرارات المتجمعة والمتكررة القصيرة المتناظرة” (كريسبر) وفي عام 2005، اكتشف عالم الأحياء الدقيقة أن هذه التسلسلات قد فعلت للبكتيريا ما تفعله أجهزة المناعة لدينا: الحماية من مسببات الأمراض.
وباستخدام تقنية كريسبر، يمكن للبكتيريا اقتلاع قطعة صغيرة من العامل الممرض الذي غزا نظامها وتخزينها للرجوع إليها في المستقبل في المرة التالية التي تواجه فيها البكتيريا هذا العامل الممرض وستكون مستعدة بالفعل للدفاع عن نفسها. بعد إجراء مزيد من الدراسة، اكتشف العلماء المزيد حول كيفية عمل نظام كريسبر: بروتين يسمى (CAS9) من شأنه أن يقطع الحمض النووي المستهدف بعد أن يتم توجيهه مباشرة إليه بواسطة خيط من الحمض النووي الريبي.
وجد العلماء منذ ذلك الحين تقنية كريسبر في 40٪ من الجينوم البكتيري المتسلسل و 90٪ من العتائق المتسلسلة ولم يكن الأمر كذلك إلا قبل بضع سنوات، على أية حال، أن عالمة الكيمياء الحيوية جينيفر دودنا وعالمة الأحياء الدقيقة إيمانويل شاربنتير اكتشفوا أنهما يمكنهما استخدام هذا النظام الذي يحدث بشكل طبيعي كآلة قابلة للبرمجة لتعديل الحمض النووي. لقد نشروا النتائج التي توصلوا إليها في عام 2012، وبحلول عام 2013، تم نشر أوراق توضح كيف يمكن استخدام تقنية كريسبر في المختبرات لتعديل الجينات لدى البشر والفئران.

تحرير جيني أسرع وأرخص
كان نظام التعديل الجيني الجديد أرخص بنسبة 99 في المائة من الأساليب الحالية للتعديل الجيني وأيضًا أسرع بكثير – يمكن إكمال تجربة كان من الممكن أن تستغرق عامًا واحدًا في غضون أسبوع واحد فقط – لذلك بمجرد أن أدرك العلماء كيفية عمل كريسبي، بدأوا في العثور على فائدة طرق التلاعب بالنظام.
؛؛لقد اكتشفوا كيفية توجيه بروتين (CAS9) إلى النقطة الصحيحة في الحمض النووي لمنع الجين دون قطعه، وتعلموا كيفية ربط بروتين مختلف بالنظام لتنشيط الجينات الخاملة. حتى أن البعض اكتشف كيفية جعل بروتين (CAS9) يعمل على تشغيل الجين أو إيقافه استجابةً للمنبهات، مثل بعض المواد الكيميائية أو الضوء؛؛
كان النظام الجديد مفيدًا بشكل خاص للباحثين الذين استخدموا الفئران الحية في تجاربهم. لن يحتاجوا بعد الآن إلى قضاء ما يصل إلى عامين في تعديل وتربية أجيال من الفئران حتى يصلوا إلى أولئك الذين لديهم الحمض النووي المثالي لاختبار الأدوية الجديدة أو خيارات العلاج. الآن، يمكن أن يكون لديهم فأرهم المثالي في أقل من ستة أشهر. كما قال رودولف جانيش في معهد ماساتشوستس للتكنولوجيا للعلوم، “لم تعد بحاجة إلى [مهارات] بعد الآن. يمكن لأي أحمق أن يفعل ذلك”.
شاهد الفيديوهات أدناه لترى العالم الجديد للهندسة الوراثية البشرية وكيف تلعب تقنية كريسبر في تحرير الجينوم وتعديل الحمض النووي:
![]()
https://www.youtube.com/watch?v=2pp17E4E-O8
https://www.youtube.com/watch?v=EH4DmsNiZ3U
https://www.youtube.com/watch?v=TdBAHexVYzc
https://www.youtube.com/watch?v=RNRZchHaKgw
*مؤتمر أسيلومار هو مؤتمر سنوي يعقد في منتجع على ساحل أسيلومار بمنطقة باسيفيك جروف من شبه جزيرة مونتيري في كاليفورنيا ، الولايات المتحدة الأمريكية لوضع الخطوط العريضة لإرشادات السلامة لإدارة العلوم والتقنيات الناشئة.
المصادر:
- https://futurism.com/crispr-tested-on-a-person
- https://www.theguardian.com/science/2015/nov/05/baby-girl-is-first-in-the-world-to-be-treated-with-designer-immune-cells
- https://www.livescience.com/58790-crispr-explained.html?fwa
- https://cbs4indy.com/news/gene-edited-babies-stir-new-interest-debate-6-months-later/

 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية
جمييل و رائع مهندس صادق . وفقكم الله.
هذا من ذوقك الرفيع والف شكر على مرورك