يمر الدواء عبر رحلة طويلة ومكلفة جداً حتى يصل إلينا، وهذه المراحل وضعها العلماء وخبراء الدواء بعد دراسات وتجارب عديدة عبر عقود طويلة؛ لضمان أقصى درجات الأمان والفعالية للدواء.
تعالوا لنتعرف على بعضٍ من جوانب هذه الرحلة الطويلة والمضنية، التي ينتقل فيها الدواء من مرحلة إلى أخرى، قد تستغرق هذه الرحلة حوالي 10 سنوات وتكلف مئات ملايين الدولارات. والعجيب أن ما يصل الى رف الصيدلية فعلياً، هو أقل بكثير من 1٪ من الأدوية والمركبات التي جرى تطويرها في المصانع والمختبرات.
تنقسم مراحل التطوير الدوائي أساساً إلى قسمين:
أولا :المرحلة ما قبل السريرية (preclinical)
تهدف الدراسات ما قبل التجارب السريرية (الإكلينيكية) إلى تحديد مدى أقصى درجات الأمان للعقار, وهي مرحلة تتضمن كل من اختيار الهدف المراد معالجته، اكتشاف الدواء، تطوير الدواء والتجربة.
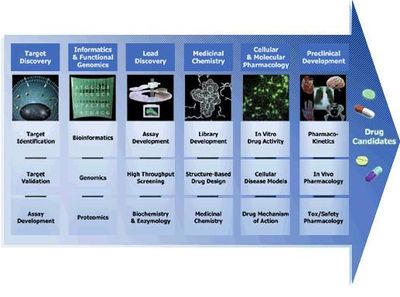
التحري والتصميم
تتضمن عملية إيجاد دواء جديد تجاه هدف مختار لمرض محدد ما، يدعى بالتحري عالي الإنتاجية
“high-throughput screening (HTS)”، والذي تختبر فيه مكتبات ضخمة تضم ملايين المركبات للمواد الكيميائية في قدرتها بتغيير الهدف.
ينبغي إيجاد مركب يتدخّل فقط مع الهدف المختار، لكن ليس مع غيره من الأهداف ذات الصلة. وللوصول لذلك فإنه تجرى عمليات التحرّي لمعرفة إذا ما كانت المركبات الناجحة “HTS” تجاه الهدف المختار ستتداخل مع الأهداف الأخرى ذات الصلة، وهذا ما يدعى بعملية التحرّي المتداخل. التحرّي المتداخل (cross-screening) هام؛ لأنه كلما طابق المركب أهداف ليست ذات علاقة، كلما زاد احتمال حدوث سمية البعد عن الهدف (off-target toxicity) وهذا يضعف احتمالية نجاح الدواء.
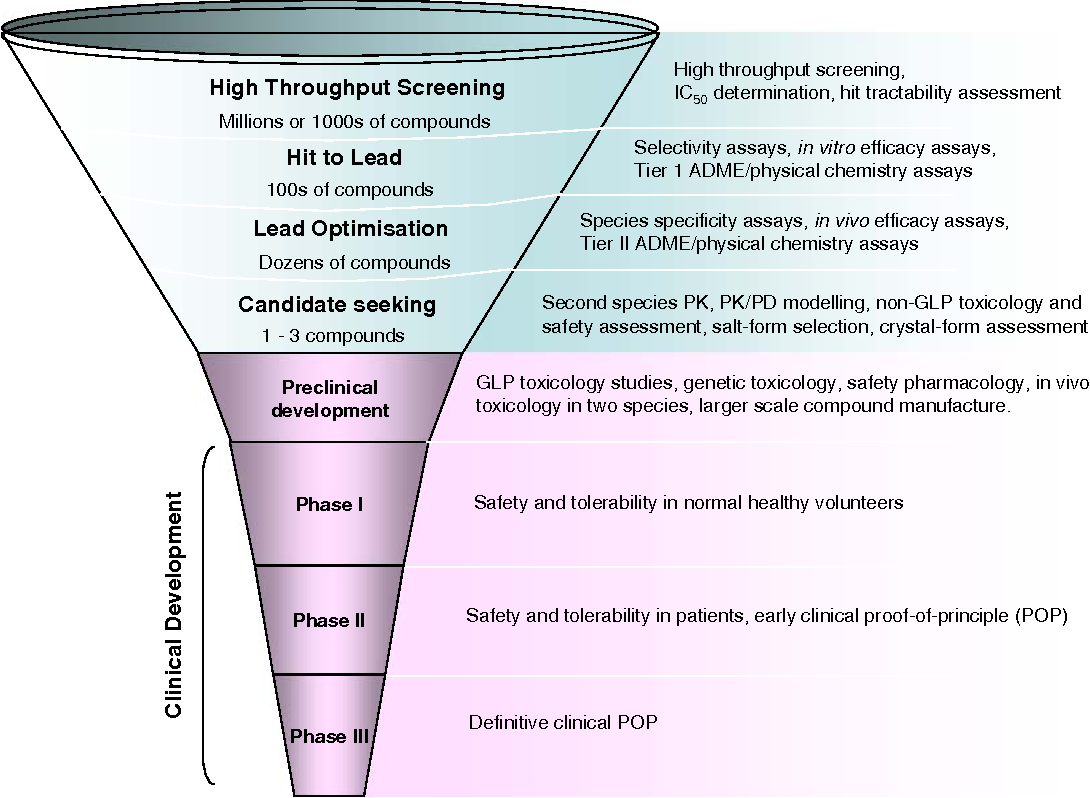
بالرغم من أن (HTS) طريقة شائعة الاستخدام في اكتشاف الأدوية الجديدة، لكنها ليست الطريقة الوحيدة. إذ من الممكن أن يجري البدء من مركب والذي يملك بالأصل بعض من الخواص المرغوبة. وهذا المركب يكون منتج طبيعياً أو حتى أن يكون دواء في السوق من الأدوية المعروفة.
عندما يتم تعيين سلاسل مركبات رئيسية مع فاعلية هدف كافية وانتقائية وخواص مشابهة للدواء مرغوبة، عندها يُقدم مركب أو مركبين للتطوير الدوائي. إن أفضلها يسمى عموماً بالمركب الرئيسي (lead compound)، بينما الأخرى ستلقّب كـ”دعم”.
تنقسم هذه المرحلة إلى عدة مراحل:
1. الهدف البيولوجي (biological target):
يجب اختيار الهدف الذي سوف يؤثر عليه الدواء أو العقار, ويسمى بالهدف البيولوجي ويقصد به البروتينات (مثل: الحمض النووي) أو قنوات أيونية أو مستقبلات للهرمون الذي يمكن تحوير نشاطها عن طريق مؤثر دوائي. يستخدم مصطلح الهدف البيولوجي في مجال البحوث الصيدلانية, لوصف البروتين الطبيعي في الجسم الذي يُحور نشاطه عن طريق استخدام العقار وبذلك ينتج عنه التأثير العلاجي المطلوب, وأيضاً يسمى (بالهدف الدوائي) (drug target).
2. اكتشاف الدواء
وهي الطريقة التي يكتشف بها تركيبة الدواء. في الماضي, كان يكتشف معظم الأدوية عن طريق تحديد المادة الفعالة في العلاجات الشعبية أو بالمصادفة. حديثا, تتضمن طريقة اكتشاف الأدوية بمعرفة المرشح المناسب وطريقة تصنيعه وخصائصه وتحليله لضمان الفعالية العلاجية، وحالما يثبت مركب ما فعاليته في هذه الاختبارات, تبدأ مرحلة التطوير الدوائي له التي تسبق مرحلة التجارب الإكلينيكية.
بالرغم من نشوء الكيمياء التجميعية كجزء لا يتجزّأ عن عملية الاكتشاف الرئيسية، فإن المنتجات الطبيعية لا تزال تلعب دوراً رئيسياً كمادة انطلاق لاكتشاف الأدوية. نُشر تقرير في عام 2007 يغطّي تفاصيل السنوات بين 1981 و 2006 في مساهمة المركبات الكيميائية المتشكلة الحيوية في تطوير الأدوية. تبعاً لهذا التقرير وجد أنه من بين 974 كيان كيميائي جديد ذو جزيئة صغيرة، كان 63% منها مشتق طبيعياً أو مشتقات نصف صناعية لمنتجات طبيعية.
3. تطوير الدواء:
يعرف مصطلح التطوير الدوائي أو ما قبل الإكلينيكي في كثير من الشركات الصيدلانية أنه عملية استخدام المركب الأساسي (active pharmaceutical ingredient API) (المادة الكيميائية الأساسية) ومرورها في مراحل ضرورية لجعلها قابلة للتجربة على البشر. وأهم مراحل تطوير الدواء هو استخدام حيوانات التجارب.
ثمة نوعان من التجارب على الحيوانات:
1. (In vitro) (كلمة لاتينية تعني داخل الزجاج) وهي تقنية تستخدم للقيام بعملية معينة، في محيط محدد خارج جسم الكائن الحي.
يهدف هذا النوع من البحوث إلى وصف آثار المتغيرات للتجارب على أجزاء من الحيوانات بديلة عن الجسم كاملاً، تميل للتركيز على الأنسجة والأعضاء والخلايا والأجزاء الخلوية والبروتينات, وهي مناسبة لتتبع ميكانيكية عمل الدواء.
2. (In vivo) (كلمة لاتينية تعني داخل الجسم) وترمز إلى استخدام الحيوان الحي كاملاً على عكس من استخدام حيوان ميت أو جزء منه.
ثانيا: المرحلة السريرية (الاكلينيكية):
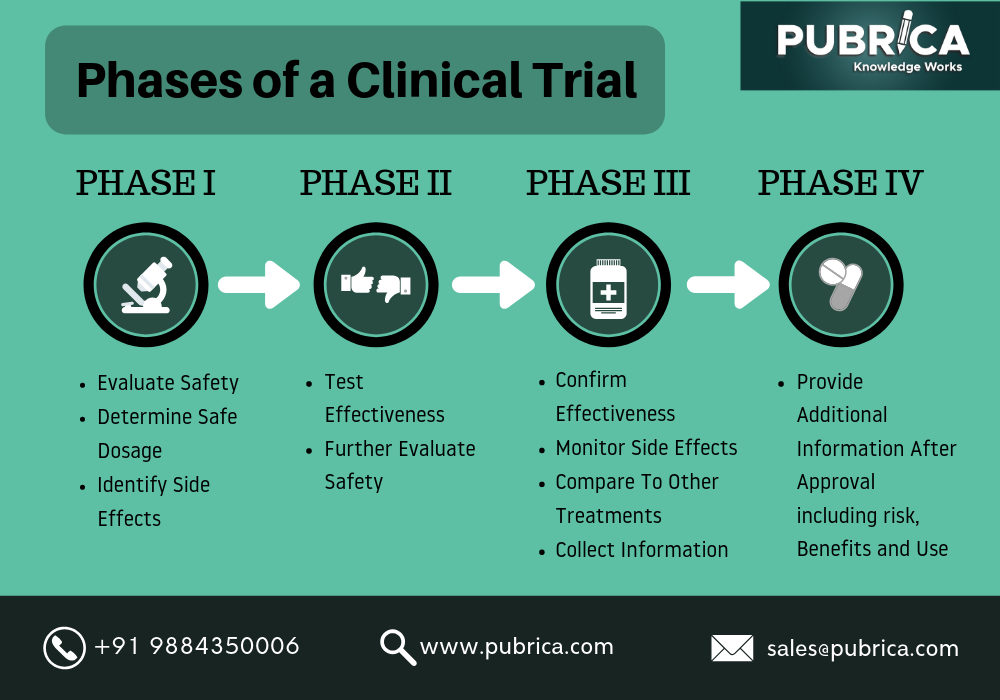
إجراء التجارب السريرية: تجرى التجارب السريرية ضمن 3 مراحل:
المرحلة الأولى:
بعد 30 يوماً من قيام شركة الصناعة الدوائية بتقديم طلب دواء تجريبي جديد الخاص بها، يمكنها البدء بالمرحلة الأولى من التجارب السريرية. تستخدم دراسات المرحلة الأولى لتقييم بيانات الحرائك الدوائية والتحمل في متطوعين أصحاء. وتتضمن هذه الدراسات دراسات الجرعة الواحدة والجرعة المتكررة قصيرة المدى وزيادة الجرعة بشكل تدريجي.
المرحلة الثانية:
المرحلة الثانية من التجارب السريرية هي تجارب صغيرة الحجم لتقييم الفعالية الدوائية الأولية والآثار الجانبية في 100 إلى 250 مريض. كما يندرج تحت هذه المرحلة دراسات السلامة الدوائية والدراسات الدوائية السريرية.
المرحلة الثالثة:
المرحلة الثالثة من التجارب السريرية هي عبارة عن دراسات واسعة النطاق للسلامة والفعالية الدوائية على أعداد كبيرة من المرضى. وفي أثناء إجراء دراسات المرحلة الثالثة يتم الاستعداد لتقديم طلب دواء جديد (NDA) (والذي يتم تقييمه من قبل مركز تقييم الأدوية والبحوث (CDER)، أو طلب ترخيص الأدوية البيولوجية (BLA) (والذي يُقيّم من قبل مركز تقييم الأدوية البيولوجية والبحوث (CBER) التابع لمؤسسة الغذاء والدواء.
بعد الانتهاء من التجارب السريرية وظهور نتائجها التي تدعم سلامة وفعالية الدواء في علاج الحالة المرضية فإنه يتم تقديم البيانات التي جمعت من هذه الدراسات إلى السلطات التنظيمية ذات الصِّلة، للحصول على الموافقة لتسويق الدواء ضمن حدودها الإقليمية. تعتبر المرحلة الأخيرة في عملية تطوير الدواء هي تسويقه وذلك بعد صدور الموافقة عليه من قبل السلطات التنظيمية. ويقوم مصنعو الدواء بطلب ترخيص تسويقه في البلاد التي يرغبون ببيع منتجهم فيها.
أما ما بعد تسويق الدواء فتأتي المرحلة الرابعة من مراحل التجارب السريرية وهي تجارب ما بعد التسويق، حيث يتم التحري والإبلاغ عن حصول أي آثار جانبية نادرة ناتجة عن أخذ الدواء وشدتها، وإجراء تجارب مقارنة بتحليل الجدوى الاقتصادية ودراسات جودة الحياة وذلك لضمان سلامة الدواء المُسوق.
تبين لنا من خلال سرد رحلة الدواء، مدى طول وتعقيد هذه الرحلة، من لحظة تطويره في المختبرات حتى لحظة اعتماده والسماح بتسويقه واستعماله، وهذا يعطينا فكرة مبسطة عن الجهود الكبيرة التي يبذلها مطورو الدواء والجهات الرقابية الرسمية، من أجل ضمان آلية صارمة، تكفل سلامة وفعالية الدواء.
*غسان علي بوخمسين ، صيدلاني أول ، مستشفى جونز هوبكنز.
 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية
