Gold nanoparticles injected into tumors could improve radiation treatment for cancer
(Devika Basnagge Chithrani – بقلم: ديڤيكا باسناغي تشيثراني)
ملخص المقالة:
يُستخدم العلاج الإشعاعي وحده لعلاج السرطان أو مع خيارات العلاج الأخرى مثل العلاج الكيميائي والجراحة، ويمكن استخدامه أيضًا لتقليص الورم قبل الجراحة. ويتم في العلاج الإشعاعي تدمير الخلايا السرطانية عن طريق إتلاف حمضها النووي. وهناك حاجة لطرق جديدة تعزز فعالية الإشعاع مع تقليل الآثار الجانبية، وتتمثل إحدى طرق تحقيق ذلك في جعل الخلايا السرطانية أكثر حساسية للإشعاع، بحيث تتلف هذه الخلايا بسهولة أكبر عن طريق العلاج الإشعاعي. وقد أظهر استخدام جزيئات الذهب النانوية كمحسنات إشعاعية نتائج واعدة. ويمكن إدخال هذه الجسيمات النانوية الذهبية عن طريق الوريد لتتراكم في الورم عن طريق استغلال الجدران المعيبة للأوعية الدموية للورم، والتي تميل لتكون مُسَرِبةً بسبب النمو السريع. وتتفاعل جزيئات الذهب النانوية مع فوتونات الأشعة السينية المستخدمة في العلاج الإشعاعي التي تنتج الإلكترونات، والتي تتفاعل بعد ذلك مع جزيئات الماء لإنتاج الجذور الحرة المدمرة للخلايا والمقللة من بقائها.
( المقالة )
السرطان هو السبب الرئيسي الثاني للوفاة على مستوى العالم. ففي عام 2018 ، كان هناك 18.1 مليون حالة جديدة و 9.5 مليون حالة وفاة مرتبطة بالسرطان في جميع أنحاء العالم. وبحلول عام 2040 ، من المتوقع أن يرتفع عدد حالات السرطان الجديدة سنويًا إلى 29.5 مليونًا، وأن يرتفع عدد الوفيات المرتبطة بالسرطان إلى 16.4 مليون.
ويمكن لحوالي 50 بالمائة من جميع مرضى السرطان الاستفادة من العلاج الإشعاعي في إدارة مرضهم. ويتم تشخيص حوالي نصف هؤلاء المرضى في وقت مبكر بما يكفي بحيث يمكن علاج السرطان لديهم. وبالنسبة للعديد من السرطانات بما في ذلك سرطان الثدي والبروستاتا وعنق الرحم والرأس والعنق وسرطان الرئة والدماغ، فإن العلاج الشافي يشمل العلاج الإشعاعي. ولكن، لأن العلاج الإشعاعي يدمر الخلايا السليمة وكذلك الخلايا السرطانية، فإن الجرعات تكون محدودة.
ويُستخدم العلاج الإشعاعي وحده لعلاج السرطان أو مع خيارات العلاج الأخرى مثل العلاج الكيميائي والجراحة. ويمكن استخدامه أيضًا لتقليص الورم قبل الجراحة. وفي العلاج الإشعاعي، يتم تدمير الخلايا السرطانية – التي تنقسم أسرع بكثير من الخلايا السليمة المحيطة الأخرى – عن طريق إتلاف الحمض النووي الخاص بها.
الآثار الجانبية تحد من جرعة الإشعاع
العامل المحَدِد في العلاج الإشعاعي هو أن الجرعات العالية بما يكفي لمحاولة علاج الأورام غير النقيلية عالية الخطورة (المتقدمة محليًا) تتسبب أيضًا في تلف الأنسجة الطبيعية المحيطة. وحاليًا، نحن في حدود جرعة العلاج الإشعاعي التي يمكن إعطاؤها للمرضى. ولزيادة تحسين البقاء على قيد الحياة، هناك حاجة لطرق جديدة تعزز فعالية الإشعاع مع تقليل الآثار الجانبية.
وتتمثل إحدى طرق تحقيق ذلك في جعل الخلايا السرطانية أكثر حساسية للإشعاع، بحيث تتلف هذه الخلايا بسهولة أكبر عن طريق العلاج الإشعاعي. وقد أظهر استخدام جزيئات الذهب النانوية كمحسنات إشعاعية نتائج واعدة. ويمكن إدخال هذه الجسيمات النانوية الذهبية عن طريق الوريد لتتراكم في الورم عن طريق استغلال الجدران المعيبة للأوعية الدموية للورم، والتي تميل لتكون مُسَرِبةً بسبب النمو السريع.
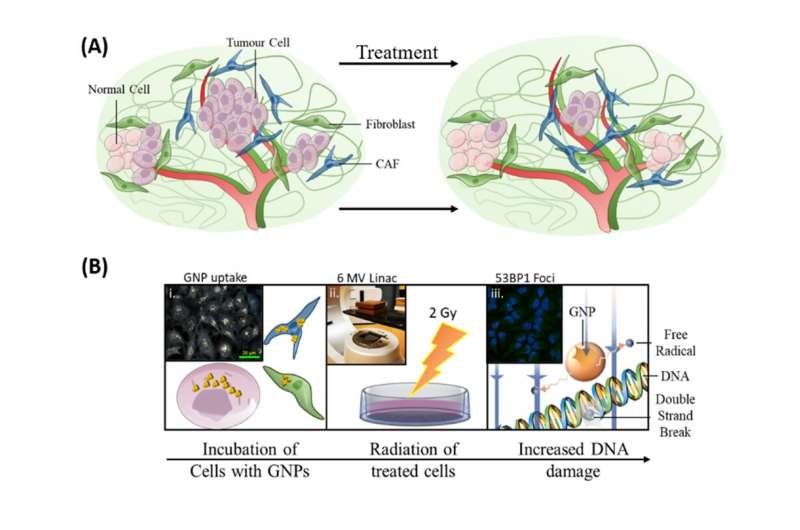
وتتفاعل جزيئات الذهب النانوية مع فوتونات الأشعة السينية المستخدمة في العلاج الإشعاعي التي تنتج الإلكترونات، والتي تتفاعل بعد ذلك مع جزيئات الماء لإنتاج الجذور الحرة. ويمكن لهذه الجذور الحرة أن تدمر الخلايا وتقلل من بقاء تلك الخلايا.
ويعد فهم النظام البيولوجي المعقد الموجود في الورم وما حوله أمرًا ضروريًا لتحسين استخدام جزيئات الذهب النانوية للتحسس الإشعاعي ، على النحو الذي حدده اتحاد المعامل ، بما في ذلك مختبر العلوم النانوية وتطوير التكنولوجيا الخاص بنا في جامعة فيكتوريا.
استهداف التفاعلات داخل الورم
في هذا العمل، نناقش أهمية البحث في المكونات الخلوية داخل البيئة المكروية للورم التي تتناول الجسيمات النانوية الذهبية وتصبح حساسة للإشعاع. ونحن مهتمون بشكل خاص بخلايا تسمى الخلايا الليفية المفعلة، والتي ترتبط بالتئام الجروح ولديها خصائص مضادة لانتاج الأورام أو الميل لإنتاجها (tumourogenic) ، بمعنى أنها تساعد في حرب نمو السرطان.
ومع ذلك، يمكن تجنيد الخلايا الليفية المنشطة بواسطة الخلايا السرطانية، وتصبح أرومات ليفية مرتبطة بالسرطان (CAFs) . وبدلًا من الخصائص المضادة للأورام، تعزز الأرومات الليفية المرتبطة بالسرطان انتشار الأورام وانتشارها.
وتدعم وظيفة الأرومات الليفية المرتبطة بالسرطان فكرة أن الأورام هي “جروح لا تلتئم”، وقد يكون استهداف الأرومات الليفية المرتبطة بالسرطان مفيدا في تحسين نتائج علاج السرطان.
وكما هو موضح في الصورة أعلاه، كان لأبحاثنا حول دمج الجسيمات النانوية الذهبية في بروتوكولات العلاج الإشعاعي الحالية ثلاثة أهداف: تعزيز قتل الخلايا السرطانية، واستهداف الأرومات الليفية المرتبطة بالسرطان وحماية الخلايا الليفية.
ولتكون فعالة في تحسين العلاج الإشعاعي، فإن الخلايا المستهدفة من قبل العلاج (تلك المرتبطة بنمو السرطان) ينبغي أن يكون لديها امتصاص عالٍ من جسيمات المحسن الإشعاعي، بينما تحتاج الخلايا المستفيدة الى امتصاص منخفض. وهذا يجعل الخلايا المستهدفة أكثر سهولة في التدمير عن طريق العلاج الإشعاعي بجرعات يمكن للمرضى تحملها.
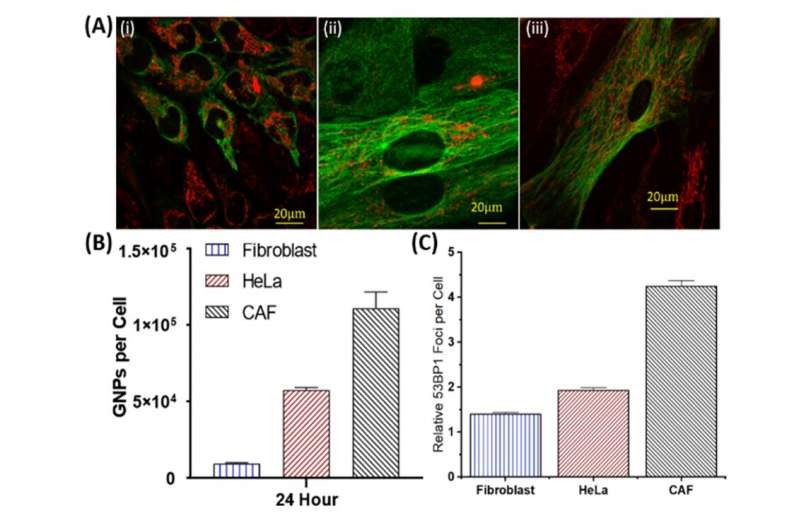
وهذه النتائج باستخدام أورام ثلاثية الأبعاد، نمت في المختبر، مشجعة للغاية. وكان لدى الأرومات الليفية المرتبطة بالسرطان الامتصاص الأكبر للجسيمات النانوية الذهبية لكل خلية، مع ما يقرب من ثلاثة أضعاف الخلايا السرطانية، في حين أن الخلايا الليفية كان لديها عدد صغير نسبيًا. وقد تُرجم هذا أيضًا إلى زيادة أكبر في تلف الحمض النووي في الأرومات الليفية المرتبطة بالسرطان مقارنة بأنواع الخلايا الأخرى، مما يقلل من نشاط الأرومات الليفية المرتبطة بالسرطان ويبطئ نمو الورم.
وهذا الاختلاف في تلف الحمض النووي بسبب الاستهداف الانتقائي للخلايا المرتبطة بالسرطان فوق الخلايا الطبيعية قد تسمح جزيئات الذهب النانوية لتكون أداة فعالة في مستقبل الإشعاع العلاجي للسرطان، مما يساعد على تقليل الأضرار التي لحقت الأنسجة الطبيعية وتحسين جرعة العلاج الإشعاعي المحلي للورم.
وتعرض هذه الدراسة أن استخدام جزيئات الذهب النانوية باعتبارها محسنًا اشعاعيًا يسمح للمزيد من الضرر ليتم نشره إلى الأرومات الليفية المرتبطة بالسرطان، هو أحد العناصر التي أظهرت أن يكون إلى حد كبير مؤثرًا في تطور السرطان. ونعتقد أن هذا العمل سيكون لبنة بناء نحو نظام علاج أكثر فعالية في المستقبل القريب. ويعتبر بناء نموذج، يمكنه تمثيل التفاعلات المختلفة التي تحدث داخل البيئة الدقيقة للورم بدقة، أمرًا ضروريًا لتحسين نتائج العلاج للمرضى.
*تمت الترجمة بتصرف
المصدر:
https://phys.org/news/2021-06-gold-nanoparticles-tumors-treatment-cancer.html
 علوم القطيف مقالات علمية في شتى المجالات العلمية
علوم القطيف مقالات علمية في شتى المجالات العلمية
